차의과학대학 차여성의학연구소 서울역센터 산부인과
착상전 유전진단은 착상전 배아 단계에서 유전질환이나 염색체 이상의 유무를 진단하여 이환 되지 않은 배아를 이식함으로써 정상적인 태아를 임신하기 위해 시행되는 방법이다. 2017년 용어 개정에 따라 기존의 착상전 유전 스크리닝 (PGS, preimplantation genetic screening) 은 PGT-A (preimplantation genetic testing for aneuploidy)로 바뀌고, 착상전 유전진단 (PGD, preimplantation genetic diagnosis) 은 단일 유전자 질환에 대한 PGT-M (PGT for monogenic disorder) 과 염색체 구조적 재배열에 대한 PGT-SR (PGT for structural rearrangement)로 나뉘었다 [1]. 이 글에서는 PGT-M 과 PGT-SR에 관하여 소개하고자 한다.
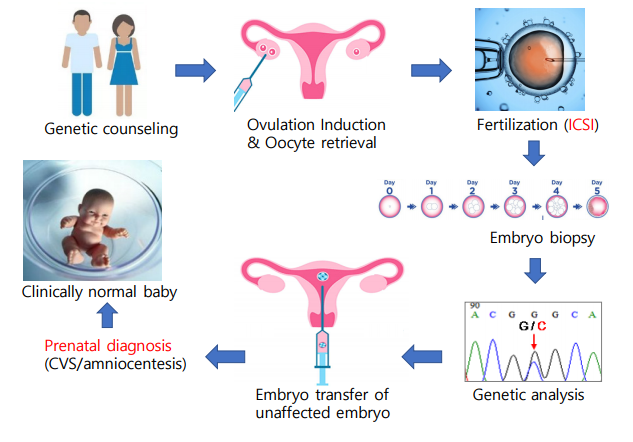 그림1. 착상전 유전 진단의 과정
그림1. 착상전 유전 진단의 과정
착상전 유전진단의 과정은 과배란 유도를 통한 체외수정 시술 (IVF-ET, in vitro fertilization and embryo transfer)을 시행하여 얻어진 배아로부터 할구세포(blastomere) 또는 영양외배엽세포(trophectoderm)를 세포를 생검하여 단일세포 수준에서 NGS (next generation sequencing), PCR (polymerase chain reaction)이나 karyomapping 기법 등을 이용한 유전진단을 시행하고, 유전병이 없거나 정상적인 염색체를 갖는 배아를 선별적으로 자궁 내에 이식하여 임신을 시도하는 방법이다 (그림1).
착상전 유전진단의 착안은 배아의 초기 발달 단계에 있어 indeterminate cleavage라는 현상에 기초한다. 즉, 8v세포기 정도의 초기 배아로부터는 한개 내지 두개의 할구세포를 떼어내도 배아는 계속 발달할 수 있다는 것이다 [2]. 최초의 착상전 유전진단은 1990년 Handyside 등이 X-linked recessive 유전질환을 가진 가계의 부부에서 정상인이나 보인자가 되는 여아를 선택적으로 이식하여 임신, 분만에 성공한 예였다. 배아의 할구 세포에서 PCR 기법을 이용하여 Y 염색체 특이 서열을 증폭시킴으로써 증폭이 없는 경우는 여아로 진단하여 배아 이식을 하였다 [3]. 이처럼 단일세포에서 소량의 DNA(약 6pg/cell)를 증폭시켜 유전 진단을 해야하므로 매우 정밀한 진단 기법 및 고도의 기술이 뒷받침되어야 하며 [4], 전 세계적으로 60여곳에서만 겨우 시행되고 있다. 우리나라의 경우 단일 유전자 이상에 대한 착상전 유전진단은 극히 소수의 병원에서만 시행되고 있으며 차병원 서울역센터는 국내에서 착상전 유전검사가 가장 활발하게 이루어지고 있는 곳의 하나로 한 해 400건 이상의 검사가 이루어 지고 있다. 최근 차병원 서울역센터는 최신NGS 장비와 염기서열 분석기, 이미지 분석 장비 등 첨단 의료장비를 보유하여 착상전 배아의 유전적 진단을 받는 환자들이 최근 들어 2배 가까이 증가하였으며, 이와 맞물려 착상전 유전진단을 통한 임신 성공율은 65%까지 증가하였다 (일반 시험관 아기의 임신 성공률은 45-50%).
1) 단일 유전자 결함에 대한 착상전 유전진단(PGT-M)을 시행하는 경우에는 먼저 임상적, 유전적으로 정확한 진단이 이루어져야 하고, 발견된 유전자 변이가 환자에게 질병을 일으킨 변이인지를 정확히 판단하는 것이 매우 중요하다. 그리고 정확한 가계도와 가능한 많은 가족 구성원에 대한 유전정보가 있어야 한다. 기술적으로는 약 6000여종의 유전병을 예방할 수 있지만 신경섬유종, 혈우병, 근이영양증, 샤르코 마리 투스 질환 등 법적으로 보건복지부에서 고시한 200 여종의 유전질환에 대해서만 착상전 유전진단을 시행할 수 있다 (2020.2월, 생명윤리법 제 50조 2항, 시행령 제 21조).
단일 유전자 질환에서는 특정 유전자 돌연변이 부위에 대한 PCR로 유전자를 증폭하여 진단한다. 이때 소수의 세포만를 증폭하여 진단을 하게 되므로 다른 세포의 혼입의 문제, 반응의 특이성 문제, allele drop out (ADO)의 문제 등이 발생할 수 있다. 차병원 서울역센터에서는 ADO를 줄이기 위하여 duplicate로 생검하거나, 민감도가 높은 multiplex PCR 기법과 함께 병을 유발하는 돌연변이 유전자 및 이와 인접한 linked polymorphic marker를 이용한 연관 분석을 이용하여 왔다. 그러나 PCR 은 환자에 따라 customized design 이 필요하여 work load 가 많고, pre-clinical test 가 오래 걸리는 단점이 있어서 이에 대한 보완책으로 karyomapping 법을 국내에서 처음으로 도입하여 활발히 사용하고 있다. 이 방법은 primer를 이용해 직접적으로 돌연변이를 확인해야 했던 PCR방법과는 달리 개인의 각 염색체에 있는 특이한 single nucleotide polymorphisms (SNP)을 분석하여 부부의 질병을 일으키는 돌연변이가 배아로 유전되는지를 간접적으로 확인하는 것이다 [5]. 즉, 부모로부터 얻은 SNP 결과를 부모 중 하나와 동일한 돌연변이를 가진 다른 가족 구성원에서 얻은 결과와 비교하여 돌연변이 유전자를 보유한 염색체와 관련된 SNP 대립 유전자의 조합을 확인하게 된다 [6]. 기존의 PCR 방법보다 준비 기간이 적게 걸려 환자들의 만족도가 높으며 본원에서 비교한 임상 결과에서도 PCR기법과 동일한 결과를 확인하였다 (그림2).
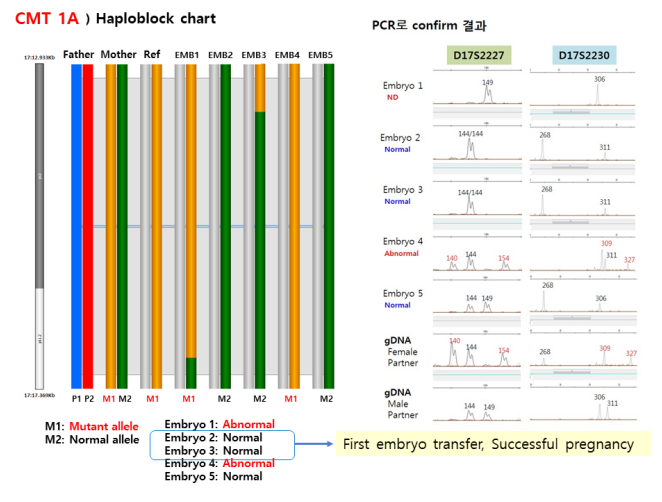 그림2. Charcot-Marie-Tooth disease (CMT)에서 karyomapping 이용한 착상전 유전진단 및 임신 후 양수검사를 통한 PCR 결과 확인
그림2. Charcot-Marie-Tooth disease (CMT)에서 karyomapping 이용한 착상전 유전진단 및 임신 후 양수검사를 통한 PCR 결과 확인
유럽 생식의학회 (ESHRE, European Society for Human Reproduction and Embryology) 산하의 PGD Consortium의 최근 보고에 의하면 착상전 유전 진단을 통해 출생한 아기들에서 건강상 또는 선천 기형 발생에 차이는 없는 것으로 보고되었다 [7]. 그러나 단일 ~ 소수의 세포를 이용한 시술이므로 진단과정의 한계나 배아의 모자이시즘 등으로 진단 오류가 있을 수 있으므로 [8], 유전병이나 염색체의 구조적 이상으로 착상전 유전 진단을 시행하여 임신이 된 경우에는 반드시 융모막 생검이나 양수검사와 같은 산전진단을 통해 태아의 이상유무를 확인해야 한다.
(2) 부부에게 염색체의 구조적 이상이 있을 때 시행하는 착상전 유전진단 (PGT-SR)은 염색체의 상호 균형 전좌 (balanced reciprocal translocation), 로벗슨 전좌 (Robertsonian translocation), 역위 (inversion), 중복 (duplication), 결실 (deletion) 등에서 시행한다. 염색체의 구조적 이상은 습관성유산의 약 5-9%에서 나타나는데, 생식세포의 감수분열 과정에서 염색체의 부분적 중복이나 결손이 발생하여 불균형 염색체를 갖는 배아가 생성됨으로써 약 80-95%에서 자연유산이 된다. 염색체 전좌를 가진 부부에서 차세대 염기 서열 분석 (NGS)를 이용한 착상전 유전검사 시 정상 배아의 비율은 약 20-25% 정도이며, 자연 임신을 시도할 경우 불균형 전좌 (unbalanced translocation)로 인한 높은 유산율과 기형아 출생을 예상된다. 따라서 착상전 유전진단으로 정상 염색체를 갖는 배아를 이식함으로써 유산율을 낮추고 임신율을 높일 수 있다 [9, 10]. 최근 차병원 서울역 센터에서는 21번 염색체의 3.3Mb 미세 중복(microduplication)으로 인한 기형아를 출산했던 부부에서 PGT-SR을 통해 정상아 임신에 성공하였으며, 과거에 8회 자연유산 경력을 가진 복합 염색체 재배열(complex chromosomal rearrangements: 3개 이상의 염색체가 관련된 구조적 이상)을 가진 부부에서도 착상전 유전진단을 통해 정상아를 분만하였다.
과거에는 유전질환이 있는 가계에서 유전병을 피하기 위해서 피임을 하거나, 임신 후 산전 진단을 통해 태아의 유전병 여부나 염색체 이상이 있는 경우 임신중절을 고려할 수밖에 없었다. 임신 중기에서 이러한 임신 중절에 따르는 신체적, 정신적 고통과 윤리적 문제가 있으며, 부부의 염색체 이상으로 인한 반복 자연유산에서는 산전 진단이 가능한 시기 이전에 유산이 일어나기 때문에 산전진단보다 더 조기에 진단할 수 있는 방법이 필요하였다. 착상전 유전 진단은 착상하기 전에 유전질환이나 염색체이상이 없는 배아를 선택하여 정상적인 태아의 임신을 성립시키는 방법으로서, 그 적응증은 계속 확대되고 있으며, NGS나 PCR, linkage analysis, karyomapping 등의 최신 기법을 이용하여 유전질환이 있는 가계에서 유전 질환의 이환아의 출생을 예방하고, 염색체 구조적 이상과 관련된 습관성 유산을 줄이고 기형아를 예방하여 정상 임신율을 높일 수 있는 매우 유용한 방법으로 사용되고 있다.
[Reference]
[1] Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, de J, Sokol R et al. The international glossary on infertility and fertility care, 2017. Hum Reprod 2017;32:1786–1801
[2] Hardy K, Martin KL, Leese HJ, Winston RM, Handyside AH. Human preimplantation development in vitro is not adversely affected by biopsy at the 8-cell stage. Hum Reprod 1990;5:708-714.
[3] Handyside AH, Kontogianni EH, Hardy K, Winston RM. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature 1990;344:768-770.
[4] Handyside AH, Robinson MD, Simpson RJ, Omar MB, Shaw MA, Grudzinskas JG et al. Isothermal whole genome amplification from single and small numbers of cells: a new era for preimplantation genetic diagnosis of inherited disease. Mol Hum Reprod 2004;10:767-772.
[5] Handyside AH, Harton GL, B. Mariani, Thornhill AR, N. Affara, M.-A. Shaw et al. Karyomapping: a universal method for genome wide analysis of genetic disease based on mapping crossovers between parental haplotypes. J Med Genet 2010;47;651-658
[6] Carles Giménez, Jonás Sarasa, César Arjona, Ester Vilamajó, Olga Martínez-Pasarell, Kenny Wheeler et al. Karyomapping allows preimplantation genetic diagnosis of a de-novo deletion undetectable using conventional PGD technology. Reprod Biomed Online, 2015;31;770-775
[7] ESHRE PGT Consortium Steering committee, Carvalho F, Coonen E, Goossens V, Kokkali G, Rubio C, Meijer-Hoogeveen M, Moutou C, Vermeulen N, De Rycke M. ESHRE PGT Consortium good practice recommendations for the organisation of preimplantation genetic testing. Hum Reprod Open 2020;3;301-313
[8] De Rycke, V Goossens, G Kokkali, M Meijer-Hoogeveen, E Coonen, C-Moutou ESHRE PGD Consortium data collection XIV-XV: cycles from January 2011 to December 2012 with pregnancy follow-up to October 2013, Hum Reprod 2017; 32:1974-1994
[9] Munne S, Cohen J, Sable D. Preimplantation genetic diagnosis for advanced maternal age and other indications. Fertil Steril 2002;78:234-236.
[10] Lim CK, Jun JH, Min DM, Lee HS, Kim JY, Koong MK, Kang IS. Efficacy and clinical outcome of preimplantation genetic diagnosis using FISH for couples of reciprocal and Robertsonian translocations: the Korean experience. Prenat Diagn 2004;24:556-561.

