인하의대
희귀 질환은 전 세계 공중 보건의 최우선 과제중 하나로, 전 세계적으로 약 3억명의 희귀질환 환자가 존재하는 것으로 추정되고 있습니다. 또한, 희귀 질환은 고소득 국가에서 아동 사망과 장애의 주요 원인으로, 미국의 경우 소아 및 성인 희귀 질환 환자의 입원 비용이 전체 의료비의 절반을 차지하고 있습니다.
희귀 질환 연구 및 진단검사에 유전체 시퀀싱을 도입하면서 희귀질환의 진단율이 증가하고, 질병의 근본적인 메커니즘을 밝히게 되었습니다. 시퀀싱 비용의 감소, 변이 해석의 발전, 결과보고까지의 시간을 단축함으로써 희귀 질환의 선별검사로서 유전체 시퀀싱에 대한 기대가 커지고 있습니다.
신생아 선별검사(newborn screening, NBS) 프로그램에 유전체 시퀀싱을 도입하면, 질환을 조기에 진단하여 치료함으로써 합병증 및 사망률을 감소시킬 수 있습니다. 그러나, 이는 동시에 여러 기술적, 윤리적, 법적, 경제적 이슈를 비롯하여 유전체 정보 보안과 관련된 문제를 야기시킬 수 있습니다. 전세계적으로 여러 대규모의 유전체 검사 기반 신생아 선별검사 관련 연구가 시작되면서, NBS 프로그램에 유전체 검사를 도입하는 것에 대한 타당성을 검토하고, 성공적인 도입을 위해 고려해야할 이슈에 대한 논의가 필요한 시점입니다(그림 1).
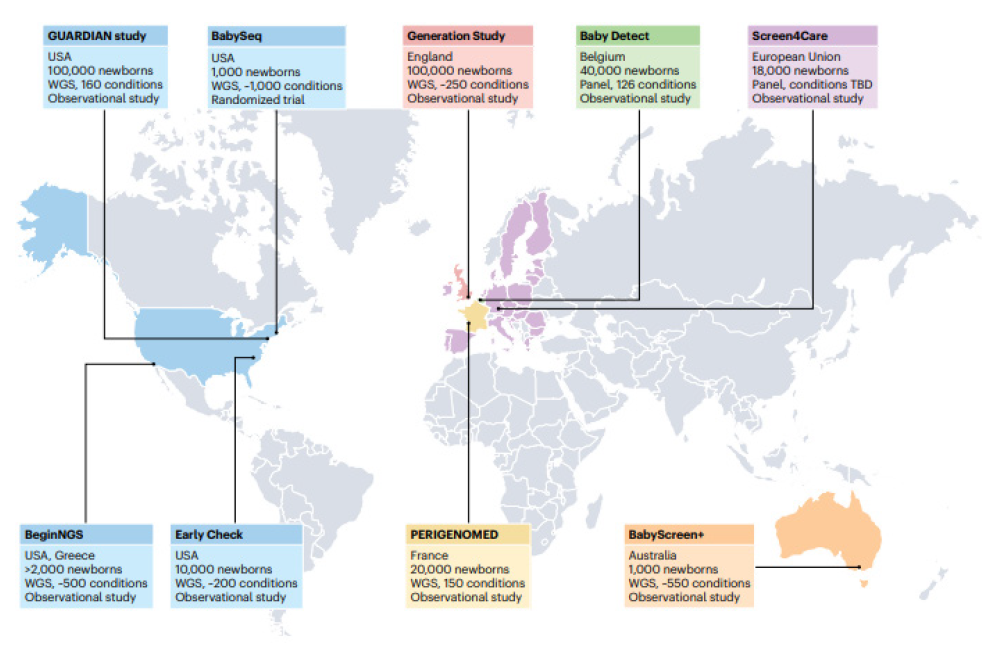 그림 1
그림 1
Large-scale genomic newborn screening studies launching internationally.
Genomics and rare diseases 시퀀싱 기술의 발전으로 희귀 질환 환자를 포함한 수천 명의 개인 유전체데이터를 생성할 수 있게 되었고, 이것은 괄목할 만한 희귀 질환의 진단과 치료의 발전으로 이어졌습니다(그림 2).
Genomic testing as a diagnostic tool
지난 10년동안 유전체 시퀀싱은 희귀질환 진단의 혁신적인 발전을 이끌었으며, 새로운 유전자의 발견 또한 놀라운 속도로 이루어지고 있는데, 매년 수백 건의 질병과 연관된 새로운 유전자가 보고되고 있습니다. 이 놀라운 발전은 연구 뿐만 아니라 실제 임상 진단에도 적용되어 희귀질환에서 유전체 시퀀싱은 현재 1차 검사로 사용중인 염색체 마이크로어레이 검사보다 진단율이 최소 2배 이상 높고, 특히나 중증 신생아에서 1차 검사로 유용하다는 연구 결과들이 전세계적으로 발표되었습니다.
Treatments for rare diseases
현재, 치료 가능한 희귀 유전질환은 10% 미만으로 치료법 으로는 대사장애에 대한 식이요법이나 보충제 투약 등의 ‘ 전통적인’ 치료법, 낭포성 섬유증에서 예방적 항생제, 기도 청소 및 식이요법개입, 중증면연결핍증에서 골수이식, 암소인 증후군에서 종양감시 등이 있습니다. 희귀질환에서 새로운 치료법의 개발은 막대한 비용이 들고 특히 새로운 치료법의 안전성과 유효성을 입증하기 위한 적절한 규모의 코호트를 모집하는 것이 불가능한 실질적인 어려움이 있습니다. 그러나 질환의 유전학적 메커니즘에 대한 이해도가 높아지면서 저분자성 물질, 올리고뉴클레오타이드, 유전자및 단백질 대체치료, 유전자 편집, 줄기세포치료 등의 정밀 치료법이 증가하고 있고, 낭성 섬유증, 척수성 근위축증, 혈우병 B, 연골무형성증, 극희귀질환(심지어 'N-of-1') 등에서 환자 예후를 변화시키고 있습니다.
Current challenges in rare disease diagnosis and treatment
현재 희귀질환 의심 환자의 30-50%만이 유전체 검사로 진단되고 있습니다. 또한, 유전체 검사의 불공평한 보급, 대규모 학술 센터에서만 가능한 정밀 치료법의 제공 등은 희귀 질환의 진단과 치료에서 여전히 큰 장벽으로 남아 있으며, 유전체 검사에서 치료 가능한 질환이 신속하게 진단되더라도 이미 병이 진행되어 치료를 통해 되돌릴 수 없는 경우도 많습니다.
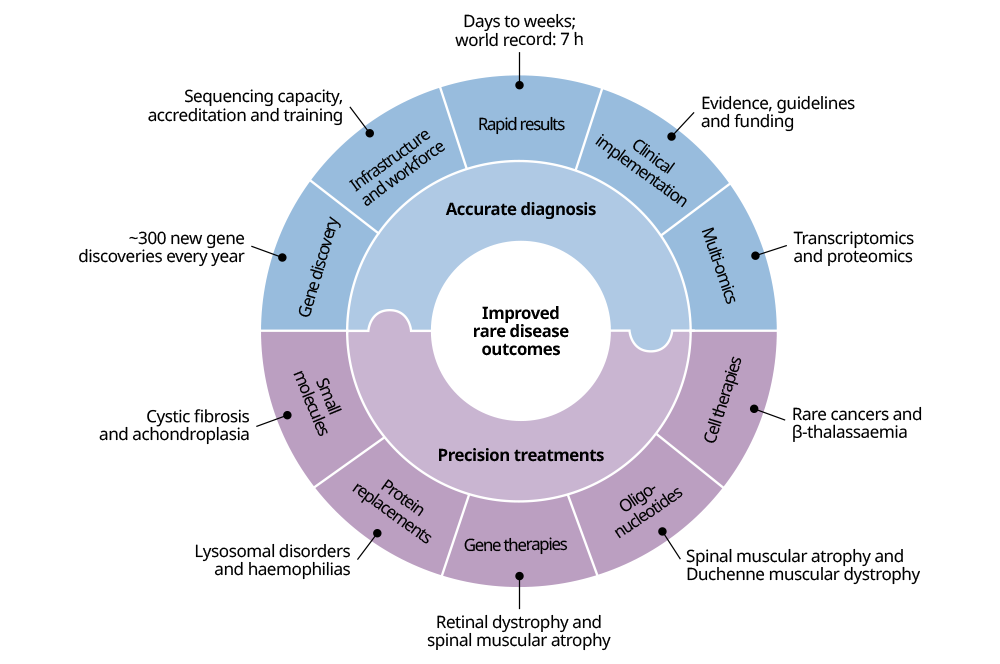 그림 2
그림 2
The impact of genomic sequencing on rare disease diagnosis and treatment.
Newborn screening and genomics 진단 프로그램과 달리 선별검사 프로그램은 질병의 초기 단계에 있는 환자나 발병 위험도가 높은 무증상 환자를 조기 진단하여 치료, 예방 및 관리하는 것을 목표로 합니다. 유전체 검사 기술은 선별 질환의 범위를 확대하고, 개인 맞춤형 치료의 기회를 높여, 바야흐로 ‘정밀 공중 보건’ 시대의 도래를 예견하고 있습니다.
Newborn screening
미국 질병통제예방센터는 NBS 프로그램을 전세계적으로 10대 공중보건업적의 하나로 선정하였습니다. 현행 NBS 프로그램은 대사이상 질환에 대한 화학검사, 청력검사, pulse oximetry 등으로 구성되어 있습니다. 유전자 검사는 전통적으로 확진 검사, 자녀 계획을 위한 2차 검사로 사용되었으나, 최근 일부 국가에서 1차 검사에 통합되기 시작 하였는데, 대표적으로 척수성 근위축증에 대한 유전자 검사가 그 예입니다.
Opportunities offered by genomic newborn screening
현재 NBS 프로그램에는 치료 가능한 희귀 질환 중 5% 미만의 질환이 포함되어 있습니다. NBS 프로그램에 유전체 시퀀싱 검사를 적용하면, 기존의 화학적 검사방법으로 검출 가능한 것 보다 더 다양한 종류의 희귀 질환을 선별할 수 있습니다. 또한, 새로운 치료법이 개발되면, 최소의 비용으로 신속하게 해당 질환을 선별할 수 있으며, 현 선별검사의 단점중 하나인 미숙아, 중증 신생아, 만삭아 등 다양한 임상상황에 따른 차이가 없이 동등한 검사 결과를 보입니다.
또한, 유전체 데이터는 대상자의 전생애에 걸쳐 건강 이익을 위해 활용될 수 있습니다. 적절한 동의를 득한 후, 보관 되어 있는 유전체 데이터를 이용하여 희귀질환 연구를 진행하고, 성인 발병 질환에 대한 위험, 열성 유전 질환에 대한 보인자 상태, 약물유전체 변이도 확인할 수 있습니다.
Challenges in genomic newborn screening
그러나 유전체 신생아 선별 검사는 이득을 줄 수도 또 피해 를 야기할 수도 있습니다. 선별검사의 잠재적 피해에는 선별 검사 자체, 추가 검사 및 치료 과정에서 발생할 수 있으며, 심리적 불편감, 경제적 부담, 신체적 불편함 등이 포함될 수 있습니다. 또한 유전체 검사 서비스에 대한 부담 증가, 전반적인 비용 상승, 검사 관련 자원의 재배치 등은 국가 의료 시스템에 부담이 될 수도 있습니다. NBS 프로그램에 유전체 시퀀싱 검사를 적용하면 현행 NBS 프로그램의 전 검사 과정에 걸쳐 다음과 같은 추가적인 요구사항이 발생합니다. 즉, 부모의 동의를 얻어 참여를 유도할 수 있는 충분한 인프라가 필요합니다. 또한, 저렴한 비용으로 신속하게 대량의 유전체 검사를 시행하고, 무증상 신생아를 위한 복잡한 다학제적 치료가 보장되어야 하며 개인정보 보호와 보안을 유지하면서 데이터 저장 및 사용을 위한 적절한 시스템을 설계하고, 성능 모니터링과 평가를 적절하게 수행해야 합니다(그림 3).
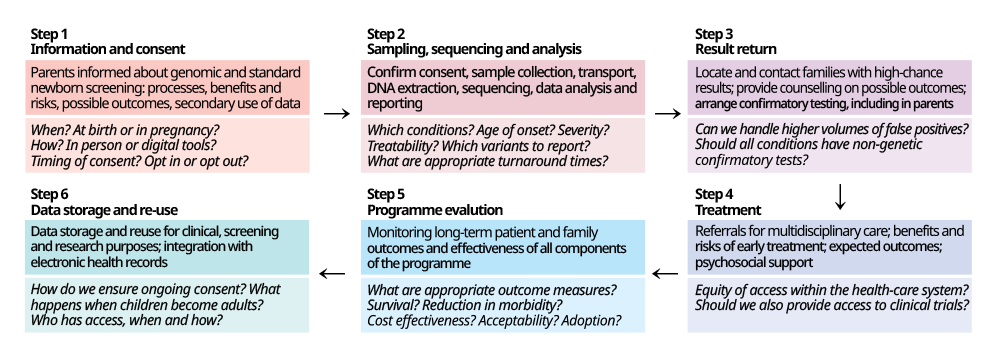 그림 3
그림 3
Stages in newborn screening programmes. Steps in the newborn screening pathway (darker boxes) and key considerations for incorporating genomic sequencing into NBS programmes for each stage (lighter boxes) are shown.
Current evidence for the implementation of genomic newborn screening 모든 신생아를 대상으로 시행하는 유전체 시퀀싱은 2009년부터 미국 의회에서 논의되었으며, 2010년에는 Newborn Sequencing in Genomic Medicine and Public Health 컨소시엄이 결성되었습니다. 검사 설계 및 성능, 진단율, 임상적 유용성 및 비용 효율성, 그리고 부모 및 의료 서비스 제공자의 견해와 우려와 관련된 중요한 문제를 다루는 연구들이 시작되었습니다.
Views of the public, parents and health professionals
일반 대중, 특히 부모들은 전반적으로 신생아 유전체 선별 검사(genomic NBS, gNBS)에 긍정적인 의견을 보입니 다. 많은 연구에서 참여한 대부분의 부모들은(>70%) 치료 가능한 소아 발병 질환에 대한 정보를 제공받는 것을 선호 했고, 상당수에서는 치료 불가능한 소아 발병 질환 및 성인 발병 질환 정보에도 관심을 보였습니다. 특히, 검사의 민감 도를 높이는 것 보다는 선별 검사 결과가 명확하고 확실한 것을 더 선호하는 경향을 보였습니다. 의료 전문가 및 관련 학회의 입장은 보다 신중한 편으로, NBS 프로그램에서 유전체 시퀀싱을 도입하는 것이 현재로서는 시기상조이지만, 향후 10년 내에 도입될 것이라 예측하고 있습니다. 전문가 들은 검사 도입의 타당성, 실질적 및 윤리적인 문제가 먼저 해결되어야 한다는 의견입니다.
Test design and performance
인구 집단 차원의 gNBS 제공을 위해서는 대규모 검사를 수행하고 신속하게 결과를 제공할 수 있는 검사실 시스템을 개발하고, 낮은 위양성률을 유지할 수 있어야 합니다. gNBS 패널에 포함시킬 유전자와 질환을 선별하는 연구들도 시행되었는데, 분석적 및 임상적 타당성, 발병연령, 침투도, 치료 효능 등을 고려하여 최종 388개에서 954개에 이르는 유전자가 선별되었으며, 선별 질환의 차이는 추후 표준화 과정이 필요함을 시사합니다. 검사실에서는 gNBS에 특화된 파이프라인을 이용하여 수일내로 결과를 보고하는 것이 가능함을 확인하였으나 이러한 연구는 주로 보관된 검체로 수행되어, 실시간으로 대규모의 검사가 가능한지는 아직 입증되지 않았습니다. gNBS의 성능평가는 주로 표준 NBS 및 진단적 전장 유전체 시퀀싱(WGS)과 비교하는 연구로, 대부분 후향적으로 진행되었습니다.
Prospective cohort studies
지금까지 미국에서는 세 개의 gNBS 전향적 코호트 연구 결과가 보고되었습니다: First 1,000 Days of Life and Beyond Longitudinal Cohort Study; North Carolina Newborn Exome Sequencing for Universal Screening (NC NEXUS) study; BabySeq.
가장 종합적으로 평가된 연구인 BabySeq 프로젝트에서는 127명의 정상 신생아와 32명의 중증 신생아로 구성된 두코호트에서 유전체 분석을 시행하였습니다. 15명(9.4%)이 소아 발병 질환의 위험이 있었고, 3명(3.5%)은 성인 발병 질환의 위험이 있었으며, 88%의 신생아는 열성 유전 질환의 보인자, 5%에서 약물유전체 변이가 확인되었습니다. 표준 NBS 결과(청력 검사 포함)와의 비교에서 NBS를 통해 진단되었으나 엑솜 시퀀싱으로는 진단되지 않은 유아 2명, 반대로 엑솜 시퀀싱으로 진단되었으나 NBS로는 진단되지 않은 유아 15명이 확인되었습니다. 특히, 출산 전에는 검사에 관심을 보였으나, 출산 후 연구에 참여하지 않는 경우가 많아, 연구 등록률이 10% 미만으로 낮았습니다. 연구 등록을 거부한 이유는 연구의 복잡성, 부담감, 무관심, 보험 문제, 불확실하거나 부정적인 결과에 대한 걱정 등 다양했습 니다. 연구에 참여한 부모들은 gNBS의 위험보다는 이득을더 높게 평가하였으며, 대부분 예방, 치료 가능한 소아 발병 질환(86.6%), 성인 발병 질환(84.6%)에 대한 정보를 받는 것에 긍정적이었습니다. 다른 연구 결과와 마찬가지로, 현행 NBS 프로그램에 포함된 질환보다 더 다양한 질환에 대한 정보를 받는 것을 선호하는 결과를 보였습니다.
Cost-effectiveness
현재까지 비용 효율성에 대하여 평가한 연구는 없습니다. BabySeq 코호트를 기반으로 한 개념증명연구에 따르면, gNBS는 비후성 심근병증에서는 비용 효율적이지 않은 것으로 나타났습니다.
Lessons from genomic screening in adults
유전체 시퀀싱은 건강한 성인을 대상으로 한 인구 집단 차원의 선별검사로도 제안되었습니다. 선별검사의 실행 가능성을 입증한 연구를 통해 선별 파이프라인 개발, 온라인 의사결정 지원 및 동의 방법, 챗봇, 전자 의료 기록과의 통합, 심리사회적 및 실행 결과 측정에 대한 경험을 배울 수 있습니다.
Future directions gNBS가 공중보건프로그램으로 도입되기 위해서는 여전히 많은 근거가 필요합니다.
The current landscape
국제적으로 북미, 유럽, 호주 등 여러 보건 시스템에서 gNBS에 대한 대규모 전향적 연구들이 이제 막 시작되고 있으며, 코호트 크기는 1,000명에서 100,000명의 신생 아까지 다양합니다. 현행 NBS 프로그램에 통합되는 모델부터 별도로 시행하는 gNBS 모델까지 다양한 검사 모델을 평가할 예정이며, 치료 가능한 소아 발병 질환을 평가 외에도 일부 연구에서는 치료 불가능한 질환, 성인 발병 질환들을 포함하여 평가하고 있습니다. 대부분은 다기관 연구이지만, 일부는 다국적 컨소시엄을 구성하여 다양한 환경에서의 시행 경험 뿐만 아니라 환자와 가족의 결과에 대한 데이터를 수집합니다. 새로 설립된 International Consortium for Newborn Sequencing은 세계 각국의 연구자들의 공동 연구를 통한 국제 표준화를 목표로 하고 있습니다.
Key research priorities
이러한 대규모 연구를 통해 환자 및 가족에서 단기 및 장기 예후, 비용 효율성, 실행 가능성, 수용 가능성 등의 광범위한 지표를 종합적으로 평가할 수 있습니다. 서비스의 형평 성, 도입과 같은 장기적인 목표를 어떻게 달성할 것인지와 장기 예후를 평가하기 위해 필요한 동의 과정과 인프라 구축에 대한 계획은 연구 초기에 고려해야 합니다. 또한, 환자와 가족에 대한 평가 결과는 의료기술평가에서 핵심적인 요소입니다. 다양한 질환과 보건의료 환경의 결과를 비교 하기 위하여 표준화된 지표를 사용하여 결과의 임상적 타당성과 유용성을 확인하는 것이 중요합니다. 보건의료 시스템 관점에서는 표준 NBS 프로그램 검사 시간내에 대규 모로 시행되는 gNBS 모델의 검사 전, 검사중, 검사 후 구성 요소의 실행 가능성과 수용 가능성에 대한 평가를 우선적 으로 고려해야 합니다. 우리는 gNBS를 시행함으로써 인구 집단 차원에서 조기 진단과 치료에 대한 공평한 접근성이 확대될 것을 기대합니다. 대규모 gNBS 연구는 형평성 문제를 특별히 고려하여, 공평한 결과를 최적화하기 위한 전략을 의도적으로 설계하고 배치하여 평가해야 합니다.
Conclusions and perspective 향후 유전체 시퀀싱 검사는 고도로 전문화된 검사에서 인구 집단 차원에서 이용 가능한 보건의료자원으로 전환될 가능성이 있습니다. 대규모 연구를 통해 gNBS 도입에 따른 개인 및 사회적 이득이 확인된다면, 신생아 유전체 선별 검사의 광범위한 사용을 기대할 수 있을 것입니다.
[References]
[1] Stark, Z., Scott, R.H. Genomic newborn screening for rare diseases. Nat Rev Genet 24, 755–766 (2023). https://doi.org/10.1038/s41576-023-00621-w

