울산의대
서론
염색체마이크로어레이검사(chromosomal microarray analysis, CMA)는 발달지연, 정신지체, 자폐스펙트럼장애, 다발성 기형을 가진 환자에서 가장 처음(first-tier) 시행할 수 있는 진단검사로 임상검사실에서 활용되고 있고, 우리나라는 2019년 7월 보건복지부 고시에 의해 고해상도 염색체마이크로어레이검사 검사항목이 요양급여로 적용되기 시작하였다.
CMA 플랫폼은 array comparative genomic hybridization (array CGH) 기반과 SNP 기반의 2가지가 있으며, array 에 탑재된 probe의 설계, 즉 전체 염색체 및 유전자 부위에 분포된 밀도와 배치에 따라 해상도가 결정된다. 국내 식품의약 품안전처에 승인된 CytoScan Dx Assay (ThermoFisher Scientific)은 SNP 기반으로서 750,000개의 SNP probe와 1.9 million non-polymorphic probe의 총 2.69 million probe를 포함하며 25 kb 이상의 copy-number loss와 50 kb 이상의 copy-number gain을 검출하도록 고안된 고해상도 플랫폼이다. CytoScan Dx Assay가 현재 임상검사실에서 사용되는 CMA 중에서 가장 높은 해상도를 보이지만, exon의 평균 크기가 150 bp이기 때문에 exon-level에서 single 또는 multiple exon CNV 검출은 불가능하다.
유전 질환에서 유전적 원인과 빈도는 다양하며, missense 변이가 50% 이상으로 가장 흔하고, nonsense, frameshift 외에 exon deletion/duplication도 10% 정도를 차지한다. Exon-level에서 CNV 분석은 targeted approach의 multiplex ligation-dependent probe amplification (MLPA), quantitative PCR이 있고 genome-wide approach로서 exon-level array가 있다. 본 글에서는 최근 상품화된 exon-level array의 설계 디자인을 소개하고, 유전 질환에서 진단 사례들을 통하여 임상적 유용성에 대해 다루고자 한다.
Exon-level array 설계
염색체마이크로어레이검사 플랫폼은 유전자 부위나 유전자 종류에 따라 probe의 분포 차이가 있지만 염색체 전체 영역을 검색하도록 고안되었다. 그러나 exon-level array 는 대부분의 probe가 단백 코딩 유전자의 엑손 영역에 집중되어 있다.
2022년 ThermoFisher Scientific 사에서 론칭한 exon-level array인 CytoScan™ XON Assay를 살펴 보면, 300,000개의 SNP probe와 6.5 million copy number probe의 총 6.85 million probe를 탑재하여 CytoScan Dx Assay의 2-3배 probe수를 가지고 있다.
단백 코딩 유전자를 포함하여 총 26,000개 유전자를 커버하고 특히 임상적으로 중요한 유전자 7,000여개는 level 1으로 분류하여 target exon 주변의 intron 영역까지 커버한다(Fig. 1).
CytoScan™ XON Assay의 분석적 성능은 2023년 ThermoFisher Scientific 사의 user seminar에서 발표된 바 있었고, 최근 Won 등의 보고(Won D, et al. 2024) 에 의하면 small exon-level copy number 변이 분석에서 72.7%의 민감도와 100%의 특이도를 나타냈다.
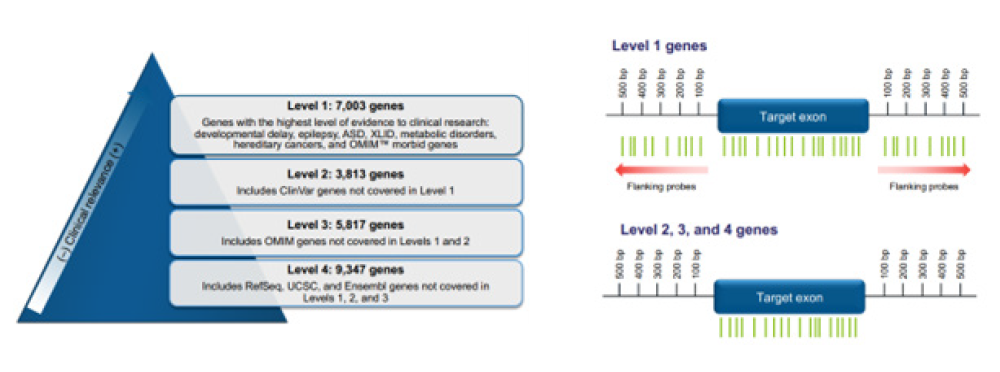 그림1
그림1
CytoScan™ XON Assay (ThermoFisher Scientific)의 probe 분포
임상적 진단 사례
사례 1)
Penon-Portmann 등은 신경 발달 장애, 간질, 소두증, 양측 구순열 및 구개열, 성장 지연, 안면 기형의 소견을 가진 8세 여아를 증례 보고(Penon-Portmann M, et al. 2023)하였다.CMA에서 8번 염색체 전체의 동형접합성을 보였고 exome sequencing에서는 TRAPPC9 유전자의 exon 2에서 동형접합 결실이 의심되었다. Exon-level oligo CGH array (ExonArrayDx, GeneDx)를 이용하여 추가 검사를 시행한 결과, 어머니는 정상이었지만 아버지는 TRAPPC9 유전자 exon 2 의 이형접합 결실을 가지고 있고 환자는 동형접합 결실이 확인 되었다(Fig. 2). 따라서 환자는 8번 염색체의 부계 단친 동종이 염색체성(paternal uniparental isodisomy)에 의해서 부계로부터 유래한 TRAPPC9 유전자 exon 2의 동형접합 결실을 가진 TRAPPC9-related neurodevelopmental disorder 로 진단되었다.
사례 2)
Alport 증후군이 의심되는 환자에서 CytoScan Dx Assay (ThermoFisher Scientific)를 이용한 CMA 검사에서 COL4A3 exon 2-26 구간의 copy number loss 소견을 보였으나 CytoScan™ XON Assay (ThermoFisher Scientific)에서는 COL4A3 exon 2-23의 결실을 나타내었다. 이러한 불일치 소견은 Fig. 3의 적색 화살표에서 보여주듯이 CytoScan Dx Assay의 경우 exon 24, 25, 26 구간에 probe가 분포하지 않기 때문이며, 모든 exon을 커버하는 CytoScan™ XON Assay는 정확한 exon-level CNV 분석이 가능하였다.
사례 3)
Elander 등은 양측 감각신경성난청을 가진 11명의 소아 환자에서 whole exome sequencing (WES)와 XON array를 시행하 였고, 6명에서 상염색체열성 감각신경성난청 유전자의 주요 변이를 찾았다(Elander J, et al. 2022). XON array의 exon-level CNV 결과와 통합 해석한 결과, 5명은 동형접합 변이로 확인 되었고 1명은 PCDH15 유전자에서 frameshift와 copy number loss의 복합 이형접합체를 가지고 있었다.
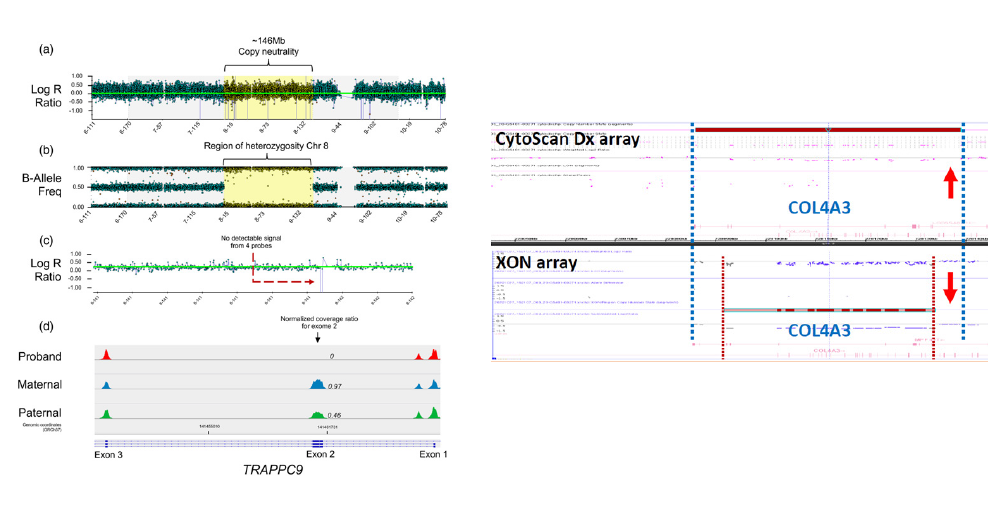 그림2
그림2
(a) 8번 염색체 전체 146Mb는 정상 copy number. (b) 8번 염색체 전체가 동형접합. 8번 염색체 isodisomy 소견. (c) 적색 화살표는 TRAPPC9 유전자 exon 2에 해당하는 4개의 probe 영역. (d) Exon-level oligo CGH array 결과, TRAPPC9 유전자 exon 2에서 환자는 동형접합 결실(0), 어머니는 정상(0.97), 아버지는 이형접합 결실(0.46) (Penon-Portmann M, et al. 2023)
앞서 기술한 유전 질환의 임상적 진단 사례들을 정리해보면, 1) whole exome/genome sequencing, NGS panel 또는 CMA 에서 exon deletion/duplication이 의심될 경우, 해당 exon의 deletion/duplication 유무를 확인하기 위해, 2) 상염색체열성 유전자에서 한 개의 이형접합 변이만 찾은 경우, 복합 이형접합 체의 가능성이 있는 exon deletion/duplication을 검출하기 위해, 3) 상염색체열성 유전자에서 동형접합 변이로 보이는 경우, exon deletion, region of homozygosity (ROH), UPD 등을 감별하기 위해 exon-level array를 활용할 수 있다.
Exon의 deletion/duplication을 MLPA 등의 검사법으로 확인할 수 있지만, 상품화된 MLPA 키트들은 일부 유전자에 국한되어 있어 whole exome/genome sequencing에서 검출되는 다양한 유전자에 적용하기 어렵다. 따라서, exon-level array는 MLPA와 비교하여 전체 단백 코딩 유전자에 대해 엑손 수준에서 deletion/duplication 뿐만 아니라 ROH도 확인이 가능한 범용 성과 적시에 신속히 시행할 수 있는 효율성을 갖고 있다.
유전 질환은 단일염기변이부터 exon deletion/duplication, large CNV까지 다양한 유전적 원인이 관여하고 정확한 진단을 위해 여러 유전자검사들이 동시에 또는 단계적으로 필요할 수 있다. 위에 정리한 사례들처럼 exon deletion/duplication, ROH 등의 확인이 필요한 경우 exon-level array는 진단적 가치가 높은 유용한 검사법이다.
[References]
[1] Won D, Yeom E, Shin S, Lee ST, Rak Choi J. Comparison of exon-level copy number variants in CytoScan XON assay and next-generation sequencing in clinical samples. Clin Chim Acta. 2024;560:119703.
[2] Penon-Portmann M, Hodoglugil U, Arun P W, Yip T, Slavotinek A, Tenney JL. TRAPPC9-related neurodevelopmental disorder: Report of a homozygous deletion in TRAPPC9 due to paternal uniparental isodisomy. Am J Med Genet A. 2023;191(4):1077-1082.
[3] Elander J, Ullmark T, Ehrencrona H, et al. Extended genetic diagnostics for children with profound sensorineural hearing loss by implementing massive parallel sequencing. Diagnostic outcome, family experience and clinical implementation. Int J Pediatr Otorhinolaryngol. 2022;159:111218.
[4] C ytoScan XON Product bulletin

