성균관의대 삼성서울병원
혈액암에서 체세포 유전자 변이는 진단, 예후, 치료 측면에서 중요한 정보를 제공한다. 따라서 혈액암에서 발견되는 수많은 체세포 변이 중 임상적으로 의미 있는 변이를 확인 하는 것은 매우 중요하다. 이를 위해 2017년 미국분자병리학회(Association for Molecular Pathology, AMP)/미 국임상종양학회(American Society of Clinical Oncology, ASCO)/미국병리학회(College of American Pathologists, CAP) [AMP/ASCO/CAP] 에서는 체세포 변이의 해석 및 보고를 위한 가이드라인을 발표하였다. 이 가이드라인은 인구 집단 내 빈도, 기능적 연구, 전산 예측, 체세포 변이의 발생 빈도 등 변이의 발암성을 결정하는 데 활용할 수 있는 근거 자료를 바탕으로, 진단, 예후, 치료와 관련된 임상적 중요성을 바탕으로 한 등급(Tier) 기반의 변이 해석 및 보고 분류 체계를 제시하였으며, 현재 체세포 변이 해석의 기본 지침으로 널리 활용되고 있다[1]. 그러나 기존 가이드라인은 변이의 발암성 분류에 대해 명확하고 세분화된 기준을 제시하지 않아 기관마다 적용에 차이가 있었다. 이에 보다 표준화된 발암성 분류를 위해 2022년 임상유전 체자원(Clinical Genome Resource, ClinGen)/암유전 체컨소시엄(Cancer Genomics Consortium, CGC)/암 변이해석컨소시엄(Variant Interpretation for Cancer Consortium, VICC) [ClinGen/CGC/VICC]에서 체세포 변이의 발암성 분류에 대한 새로운 가이드라인을 제시하였다[2].
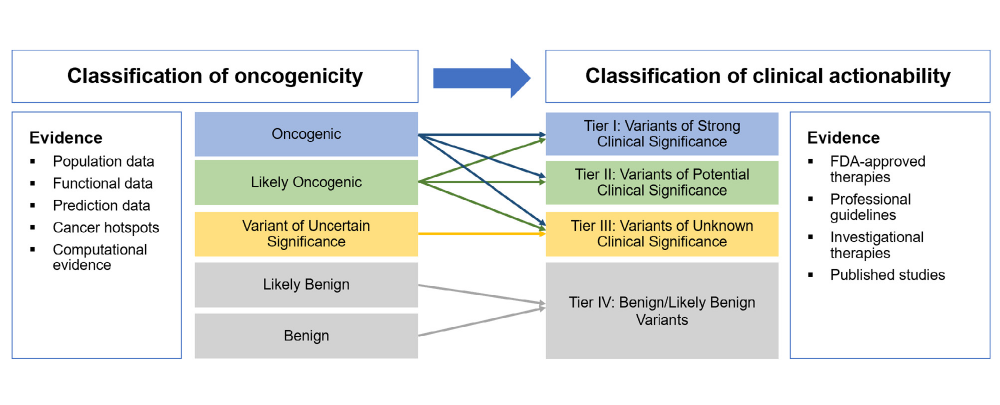 그림 1 혈액암에서 발암성 및 임상적 적용 가능성에 기반한 체세포 변이 분류 개요도
그림 1 혈액암에서 발암성 및 임상적 적용 가능성에 기반한 체세포 변이 분류 개요도
이 외에도 기존 가이드라인은 주로 고형암에 초점을 맞추고 있어, 변이의 치료적 분류 외에 진단 및 예후적 분류가 중요한 혈액암에 적용하기에는 제한적인 측면이 있으며, 이러한 문제를 보완하기 위해, 혈액암에서 체세포 변이의 해석 및 보고에 대해 벨기에와 스페인에서 생물학적 발암성 및 임상적 적용 가능성을 모두 고려한 가이드라인이 제시된 바 있다[3, 4]. 본 임상 지침에서는 혈액암 체세포 변이 해석 및 보고를 위해 변이의 발암성은 2022 ClinGen/ CGC/VICC 가이드라인을, 임상적 적용 가능성(clinical actionability)은 2017 AMP/ASCO/CAP 가이드라인을 기반으로 하여 제시하였다 .
혈액암에서 체세포 변이의 발암성 해석은 인구 집단 내 빈도, 기능적 연구, 변이 특성에 기반한 예측 데이터, 전산적 근거, Cancer Hotspots과 같은 주요 체세포 변이 데이터 베이스에서의 변이의 발생 빈도 등을 바탕으로 이루어지 며, 이를 통해 매우 강한(very strong), 강한(strong), 보통(moderate), 약한(supporting) 수준의 4가지 근거로 분류한다. 각 근거에는 각각 ±8, ±4, ±2, ±1점의 점수가 부여되며(발암성 변이의 근거인 경우에는 +, 양성 변이의 근거인 경우에는 -), 이를 합산하여 합산 점수가 10점 이상인 경우 발암성(oncogenic), 6점–9점인 경우 준발암성 (likely oncogenic), 0점–5점인 경우 의미불명변이(variant of uncertain significance, VUS), -6점–-1점인 경우 준양성(likely benign), -7점 이하인 경우 양성(benign) 변이로 분류한다. 특히 기존 데이터베이스는 고형암 중심의 변이 정보를 주로 포함하고 있어 혈액암에서 주로 관찰되는 유전자 변이에 대한 정보는 부족한 실정으로, 미국종합암네트워크(National Comprehensive Cancer Network, NCCN) 가이드라인과 혈액암에 대한 WHO 분류[5]에서 골수성혈액암에서 의미있게 검출되는 주요 유전자의 변이 형태를 제시하고 있으므로 이를 참고하면 많은 도움을 받을 수 있다.
임상적 적용 가능성은 발견된 변이가 환자의 진료지침에 영향을 미칠 수 있는지에 대한 개념이다. 특정 변이가 특정 치료에 민감성, 저항성, 또는 독성을 나타내거나, 유전자의 기능을 변화시켜 약물의 표적이 될 수 있으며, 임상시험의 포함 기준이거나 질병의 예후에 영향을 미치거나, 암의 진단 및 조기 진단에 기여한다면 해당 변이는 유의미한 변이로 해석될 수 있다. 따라서 발암성 변이가 관찰될 경우, 해당 변이의 임상적 적용 가능성은 평가 시점의 근거와 환자의 조직학적 소견을 바탕으로 진단, 예후, 치료 및 예방적 측면에서 고려되어야 한다. 혈액암에서 체세포 변이의 임상적 적용 가능성의 해석은 2017 AMP/ASCO/CAP 가이 드라인에 따라 체세포 변이 평가의 진단, 예후, 치료적 근거 수준에 따라 Level A, B, C, D의 4가지로 구분되고, 이를 바탕으로 한 Tier I, II, III, IV의 4등급 시스템(four-tiered system)으로 분류된다. Level A, B는 강한 임상적 의미를 갖는 경우이며 Tier I 변이로 분류되고, Level C, D는 잠재적 임상적 의미를 갖는 경우이며 Tier II 변이로 분류된다. 임상적 중요성이 알려지지 않은 경우 Tier III 변이로, 양성 또는 준양성 변이인 경우 Tier IV로 분류된다. 검출된 변이 중에서 Tier I, II, III 변이는 임상적 중요도 순으로 보고해야 하며, Tier IV 변이의 보고는 권장하지 않는다. 고형암에서 체세포 변이의 주요 임상적 목적이 표적치료제 선정에 있는 반면, 국내에서 혈액암 체세포 변이의 주요 확인 목적은 진단적 측면에 크게 중점을 두고 있는 것으로 나타났다. 하지만 향후 혈액암에서 표적치료제의 도입이 증가할 경우, 변이의 치료적 가치도 높아질 것으로 예상된다. 또한 클론 성조혈증(clonal hematopoiesis)과 관련된 유전자 변이는 고형암에서는 임상적 의미가 낮아 변이 해석 시 제외되는 경우가 많지만, 혈액암에서는 임상적으로 중요한 의미를 가질 수 있으므로 해석에 주의가 필요하다.
그러나 이러한 가이드라인에도 불구하고, 국내 8개 기관을 대상으로 시행된 혈액암 체세포 변이 해석 및 보고 현황에 대한 설문조사에서 모든 기관이 기존 가이드라인을 혈액암 변이 해석에 그대로 적용하기 어렵다고 답변하였다. 그 주요 이유로는 혈액암 관련 데이터베이스의 부재, 치료적 의미의 적용 어려움, 중첩되는 특성을 갖는 질환군에서의 변이 해석의 어려움, 변이에 대한 가이드라인이 잘 정립되지 않은 특정 혈액암에서의 근거 부족 등이 제시되었으며, 따라서 혈액암 변이 해석 표준화를 위한 보다 많은 노력이 필요함을 시사하였다. 본 지침은 Laboratory Medicine Online에 개제될 예정이다.
[References]
[1] Li MM, Datto M, Duncavage EJ, Kulkarni S, Lindeman NI, Roy S, et al. Standards and Guidelines for the Interpretation and Reporting of Sequence Variants in Cancer: A Joint Consensus Recommendation of the Association for Molecular Pathology, American Society of Clinical Oncology, and College of American Pathologists. J Mol Diagn 2017;19:4-23.
[2] Horak P, Griffith M, Danos AM, Pitel BA, Madhavan S, Liu X, et al. Standards for the classification of patho-genicity of somatic variants in cancer (oncogenicity): Joint recommendations of Clinical Genome Resource (ClinGen), Cancer Genomics Consortium (CGC), and Variant Interpretation for Cancer Consortium (VICC). Genet Med 2022;24:986-98.
[3] Froyen G, Le Mercier M, Lierman E, Vandepoele K, Nollet F, Boone E, et al. Standardization of Somatic Variant Classifications in Solid and Haematological Tumours by a Two-Level Approach of Biological and Clinical Classes: An Initiative of the Belgian ComPerMed Expert Panel. Cancers (Basel) 2019;11.
[4] Palomo L, Ibáñez M, Abáigar M, Vázquez I, Álvarez S, Cabezón M, et al. Spanish Guidelines for the use of targeted deep sequencing in myelodysplastic syndromes and chronic myelomonocytic leukaemia. Br J Haematol 2020;188:605-22.
[5] Khoury JD, Solary E, Abla O, Akkari Y, Alaggio R, Apperley JF, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 2022;36:1703-19.

