서울대학교
서론
특정 조직의 유전자 발현 패턴을 파악하는 것은 유전학에서 가장 근본이 되는 작업이다. 이 작업이 성공적으로 이루어 진다면 정상 조직의 발생과 분화, 혹은 질병 조직의
병리 기전을 이해할 수 있는 단초를 제공 할 것이다. 유전자 하나하나의 발현도를 측정하기 위하여 Northern blot, RT-PCR, quantitative RT-PCR 등의 전통적인 방법들이 있어
왔었으나, 전체 유전자들의 발현 패턴을 읽어내는 방법은 비교적 최근에야 가능해졌다. 2000년대 초반 RNA array법, 2000년대 후반 next-generation sequencing 기반 RNA-seq
방법이 상용화되어 최근까지 주로 사용되고 있었다. 이 중 RNA array의 경우 array 위에 심어져 있는 유전자의 발현만을 볼 수 있다는 단점이 있으나, 타겟 조직에서 발현되는
모든 RNA 분자를 읽어낼 수 있는 RNA-seq 방법으로 이 단점을 극복할 수 있었다. 하지만 이 두 방법들이 공통적으로 지닌 가장 큰 단점으로는 여러 세포 종류로 이루어져 있는
조직 ‘덩어리’를 통째로 분석한다는 것이고, 이로 인하여 조직 내 각 세포 종류의 비율과 분자유전학적 특성을 제대로 알 수 없었다. 하지만 최근 단일세포 수준으로 세포 내
유전자 발현도를 측정할 수 있는 방법들이 상용화되어 이를 극복할 수 있게 되었다.
단일세포 분석법의 원리
단일세포 전사체 기법은 크게 실험 단계와 데이터 분석 단계로 나눌 수 있다. 실험 단계는기법에 따라 차이가 있으나 2023년 현재 가장 많이 쓰이는 10x Genomics사의
Chromium플랫폼의 경우는 먼저 조직을 단일 세포로 분리하는 것에서 시작한다. 이후 각 세포마다 고유의 바코드를 부여한다. 그 후 microfluidics를 이용,
하나의 세포와 특수 bead를 기름 속에 떠 있는 하나의 물방울(droplet) 속에 채집한다. 구슬 표면에는 하나의 바코드와 poly T 서열이 다수 부착되어 있으며, 그 물방울 속에는
세포를 터트리는 버퍼와 역전사를 위한 효소 등이 포함되어있다. 따라서 각 물방울 안에서 세포 용해, poly-T를 이용한 mRNA 포획, 바코드 부착, 역전사가 일어나게 된다.
바코드를 부착한 이후에는 모든 세포에서 유래한 cDNA들을 풀링하여 증폭, 라이브러리 제작 및 시퀀싱을 진행한다 (그림 1).
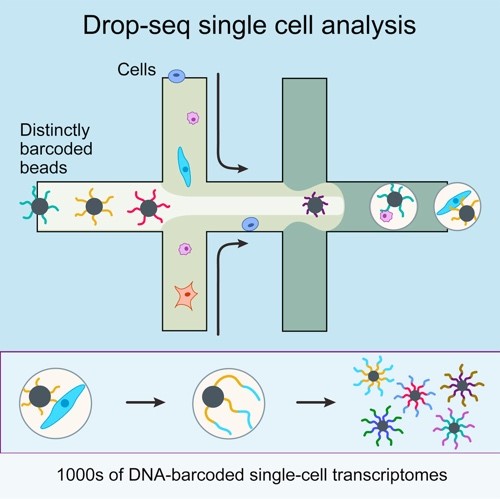 그림 1. 10X 플랫폼과 거의 동일한 원리를 이용하는 Drop-seq 연구 기법 (Macosko et al., Cell 2015)polymorphism method for the non-invasive prenatal detection
of fetal chromosomal aneuploidy.
그림 1. 10X 플랫폼과 거의 동일한 원리를 이용하는 Drop-seq 연구 기법 (Macosko et al., Cell 2015)polymorphism method for the non-invasive prenatal detection
of fetal chromosomal aneuploidy.
데이터 분석 단계에서는 시퀀싱 결과를 참조 게놈에 정렬 시키고, 세포 바코드를 이용해 각 세포별 유전자 발현량을 정량화한다. 10x Genomics 사 플랫폼을 이용할 경우 CellRanger 라는 프로그램 하나로 일련의 과정을 진행할 수 있다. 이후 단일세포 데이터를 다루는 Seurat (R)이나 ScanPy (Python)등의 패키지를 이용해 차원 축소, 군집화, 세포타입 지정, 차등 발현 유전자 검출 등의 연구 목적에 따라 적절한 분석을 진행한다.
단일세포 분석법의 응용 #1: 기초연구
단일세포전사체법의 발달에 따라, 여러 모델 생명체에서 세포를 종류별로 분리하지 않더라도 각 세포의 종류, 발현 양상을 분석할 수 있게 되었다. 또한, 기존에 알려지지 않았던
다양한 세포간의 상호작용에 대한 정보를 얻을 수 있으며, 후술하겠지만 최근에는 병리 조직에서의 공간적 위치에 따른 단일세포 수준의 전사체 분석법, 즉
공간전사체(spatial transcriptomics)법의 개발에 따라서 더욱 높은 신뢰도를 갖을 것으로 기대된다.
현재 단일세포 전사체법은 수만개에 이르는 세포를 동시에 분석할 수 있으므로, 다양한 조직의 세포 종류와 발현 양상을 포괄적으로 제공하는 Human Cell Atlas Project (https://humancellatlas.org/)등과 같이 인간의 발생과 생리현상을 세포수준에서 이해하려는 컨소시엄이나 연구 등에서 핵심적인 실험 방법으로 사용되고 있다. 또한, 인간의 뇌 발생 과정을 이해하거나 암의 유무에 따른 세포 종류, 세포 분화 과정, 상호 작용을 이해하기 위해 사용되어 특정한 상황에서 세포의 종류, 발현 패턴의 변화를 이해하는 도구로서 광범위하게 활용되고 있다.
단일세포 분석법의 응용 #2: 임상연구와 진단
임상연구에서도 단일세포전사체법은 개별 세포의 분포 및 유전자 발현을 볼 수 있기 때문에 강력한 도구가 되는데, 특히 조직 샘플을 얻기 쉬운 분야에서는 그 적용이
폭발적으로 늘어나고 있는 추세이다. 먼저 감염학 및 면역학 연구가 있겠다. 말초혈액은 비교적 비침습적으로 얻을 수 있는 샘플이기 때문에, 혈액에서 그 변화를 보기 쉬운
감염학 및 면역학 분야에서 단일세포 전사체 연구가 많이 시행되었다. 대표적으로 COVID-19를 비롯한 다양한 감염질환 환자, 자가면역환자들의 혈액 대상 단일세포전사
체법이 수행되고 있다. 또한, 여러가지 악성 종양에서 종양 세포의 이질성(heterogeneity)및 미세 환경, 종양세포의 변화과정, 종양유전자의 돌연변이 과정, 항암 치료에
대한 세포별 반응 등을 이해하기 위해 단일세포 전사체법이 이용되고 있다. 악성 종양을 표적치료 할 때, 표적이 되지 않는 종양의 일부는 재발의 원인이 되는데, 모든
종양세포에서 공유되는 큰 줄기의 돌연변이(truncal mutations)를 타깃하거나 모든 서브클론을 타깃하는 항암제 조합을 사용하는 정밀의학적 적용이 단일세포전사체법을
통해 가능할 것임이 보고되고 있다. 이 외에도 지방 간질환, 당뇨성 신장병증, 루푸스 신장병 등 다양한 조직 유래 질환들에서 단일세포전사체법을 이용해 병태생리를 이해하고
치료 타깃을 찾고 있는 연구들이 수행되고 있다.
단일세포 분석법의 전망
위에서 기술한 바와 같이 단일세포전사체법은 기초 과학 및 임상 연구의 범위와 깊이를 비약적으로 늘려주고 있으며 여전히 존재하고 있는 몇 가지 단점을 보완하기 위한
기술적 발달 또한 빠르게 이루어지고 있다. 현재 멀티플렉싱으로 여러 검체를 한번에 분석하여 배치 효과 최소화 및 비용절감 또한 가능해지고 있으며, multi-model data를
통합적으로 분석하기 위한 멀티오믹스 연구를 진행하기 위하여, 단백체 (CITE-seq), 후성유전체 (ATAC-seq) 방법을 통합하려는 방법들이 개발되고 있다.
초기 한계점으로 언급되었던 단일세포 분석법의 세포 위치 정보 손실은, 이미징 기법을 통한 공간전 사체 분석 기술로 세포 간 상호작용 패턴 등을 확인할 수 있게 되었다. 현재 상용화되기 시작하는 공간 전사체 기법으로는 10X의 Visium (그림 2), BGI의 Stereo-Seq 및 STOmics, nanostring의 CosMx SMI등이 있으며, 세포의 처리량과 정밀도가 더 높아지고 있다. 단일세포 전사체를 이미징 결과와 함께 분석할 수 있다면, 전체 조직 혹은 원하는 특정 조직의 모든 유전자 발현 정보를 단일 세포 해상도로 얻어낼 수 있을 것이며 세포의 위치 및 유전자 발현 정보를 손실 없이 얻어내는 시대가 곧 찾아올 것이다. 또한 단일세포 분석법의 개발과 다른 멀티오믹스 기술과의 연계를 통해 단일 세포의 성장과 분화, 세포 간의 조절 관계를 규명하는 것뿐만 아니라 복잡한 조직에서 세포의 이질성(heterogeneity)을 규명하여 질병의 병인 및 신약 개발에 필수적인 역할을 할 것이다.
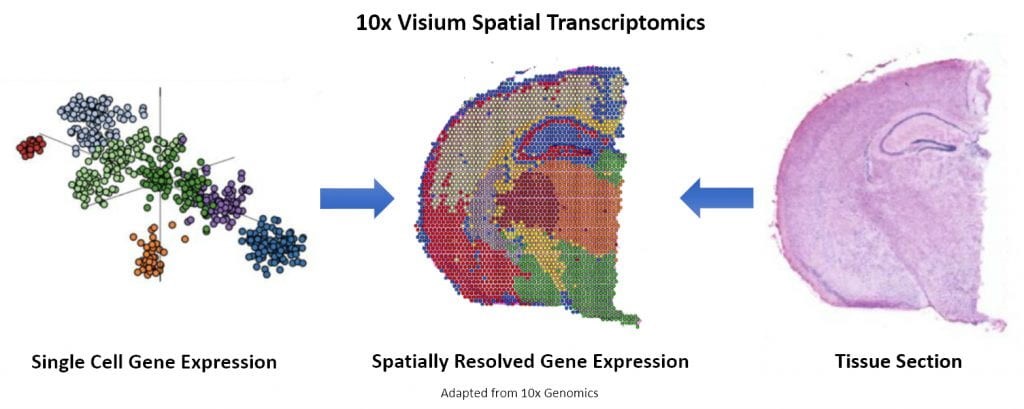 그림 2. 공간전사체법을 위한 10x Visium 방법의 개요도 (https://mygenome.asia/)
그림 2. 공간전사체법을 위한 10x Visium 방법의 개요도 (https://mygenome.asia/)

