연세의대 세브란스병원
본 지침은 선천성 복제수변이(copy number variant, CNV)의 변이 해석 및 결과 해석, 결과지 작성에 대한 내용을 중점으로 하였다.
1. 해석
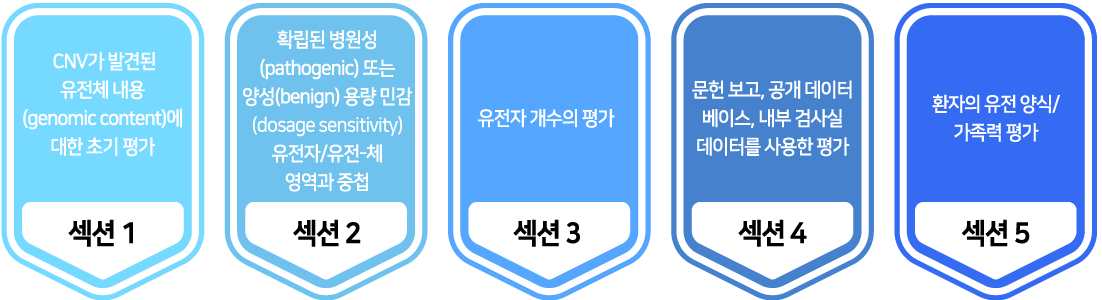
2020년 개정된 산전 또는 산후 CNV의 해석 및 보고를 위한 ACMG/ClinGen 지침은 주로 상염색체 우성 유전에 따른 유전자 또는 유전체 영역의 CNV 평가를 위해 작성되었다. CNV 해석을 위해 복제수 결실 및중복에 각각 40 종류의 확인해야 할 항목들이 있다. 각 항목들에 대해 부여된 점수 합산에 의해 CNV를 5-티어 체계(pathogenic: ≥0.99, likely pathogenic: 0.90 ~ 0.98, uncertain significance: -0.89 ~ 0.89, likely benign: -0.98 ~ -0.90, benign: ≤-0.99)로 분류할 수 있다. 각 항목들에 대해서는 일반적으로 권고되는 점수및 사용자가 상대적 강도에 따라 유연하게 선택할 수 있는 점수 범위가 있다. 항목들은 총 5개의 섹션으로 구성 되어 있고, 평가를 시작할 때는 결실인지 중복인지 확인한 다음 섹션 1부터 순서대로 각 항목들을 확인한다.
CNV의 티어를 분류할 때 개별 환자의 임상 증상과 분리하여 판단해서 한 종류의 복제수변이는 각 환자의 임상적 중요성과 관계없이 일관된 해석이 되어야 한다.
2. 보고서 작성
일반적으로 보고서에 포함되어야 하는 내용은 샘플의 출처 및 유형, 인종 정보, 샘플의 수령 날짜, 보고 날짜, 샘플 적절성, 플랫폼, 게놈 구축, 방법, 해상도 등이 포함된다. 결과는 International System for Human Cytogenomic Nomenclature (ISCN) 명명법에 따라 기술되어야 하고, 결과분석에 사용한 데이터베이스(ClinGen, DECIPHER, DGV, OMIM 등)의 출처가 기술되어야 하며, 참고문헌을 추가할 수 있다. 또한, 결과 보고의 기준, 검사의 제한점이 명시 되어야 한다. 그리고 CNV에 대한 임상적 유의성을 설명하고 필요한 경우 유전자 상담 또는 추가 검사를 권장해야 한다. 보고서에는 CNV를 보고하는 기준 (예: 변이의 분류, 변이의 크기)과 분류에 대한 설명(예: 점수 측정 기준)이 포함 되어야 한다. 검사실은 일반적으로 병원성 변이(pathogenic), 병원성 가능성이 있는 변이(likely pathogenic), 불확실성 변이(uncertainsignificance)는 모두 보고한다. 양성(benign) 또는 양성일 가능성이 있는(likely benign) CNV는 보고할 수도 있고 보고하지 않을 수도 있는데, 이러한 검사실의 보고 정책은 보고서와 실험실의 변이 보고 지침에 명시되어야 한다. CNV에 포함된 유전자는 모두 보고서에 명시되어야 한다.
1) 불확실성 변이(Variants of uncertain significance, VUS) 보고
선천성 기형/정신지체/발달 장애/자폐증 환아에서 발견되는 400 kb 이상의 VUS는 일반적으로 보고하는 것이 권장된다. 다만 400 kb 이하의 VUS라도 추후 병원성 변이로 재분류 가능성이 높을 경우 보고될 수 있다고 보고서에 명시하고 보고할 수 있다. 시간이 지나면서 데이터가 축적됨에 따라 VUS로 해석되었던 대부분의 CNV는 benign/likely benign으로 판명되지만 일부는 pathogenic/likely pathogenic으로 밝혀질 수도 있다. 때문에 의학 문헌의 주기적 검토를 위해 VUS 포함된 모든 RefSeq 유전자들을 보고서에 기술하는 것이 권장된다.
2) 이중접합부재(Absence of heterozygosity, AOH)의 보고
부모가 혈족관계가 아닌 경우, 하나의 염색체에서 10 Mb 초과 크기(각 검사 실에서 기준을 다르게 설정할 수 있음)의 이중접합부재(Absence of heterozygosity, AOH)가 관찰된다면 유전체 각인질환(imprinting disorder) 연관 염색체(예: 6, 7, 11, 14, 15번 염색체) 해당 여부를 확인하고 단친이염색체성 (Uniparental disomy) 질환 가능성에 대해서 보고해야 한다. 부모간 혈족관계인 경우, AOH는 임상에서 요청이 있지 않은 이상 보고되어서는 안된다.
3) 검사 이유와 관계없이 발견되는 변이 또는 보인자로 발견된 변이에 대한 보고
검사 이유와 관계없이 발견되는 임상적으로 중요한 변이 또는 보인자로 발견된 변이에 대해 검사실마다 정책을 수립해야 하고, 임상 보고서에는 그러한 정책을 명시할 수 있다. 표1에 부수적으로 발견되는 복제수변이 보고에 대한 일반 권고사항을 기술하였다.
| 보인자 상태의 보고 |
|---|
|
- 일반적으로 보인자 상태의 CNV 보고는 권장되지 않는다. - 만일 검사실이 보인자 상태의 CNV를 보고하는 방침을 세운 경우, 의뢰와 연관된 일차 보인자 상태의 CNV와 의뢰와 상관없는 이차 보인자 상태의 CNV를 구분하여 보고 여부를 결정한다. |
| 증상이 나타나기 전 또는 진단되기 전 발견된 변이의 보고 |
| - 증상이 나타나기 전 상태와 관련된 CNV는 의료에 대한 조기 접근을 용이하게 하기 위해 일반적으로 보고되는 것이 권장된다. |
| 암의 위험도를 증가시키는 변이의 보고 |
| - 침투도, 암 발생 위험, 관련된 암 등에 대하여 잘 알려져 있고 인간에게 잘 알려진 돌연변이가 발견된 종양 억제 유전자에 대한 결실은 보고되는 것이 권장된다. |
[참고 문헌]
1. Riggs ER, Andersen EF, Cherry AM, Kantarci S, Kearney H, Patel A, et al. Technical standards for the interpretation and reporting of constitutional copy-number variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics (ACMG) and the Clinical Genome Resource (ClinGen). Genet Med 2020;22:245-57.
2. Kearney HM, Thorland EC, Brown KK, Quintero-Rivera F, South ST. American College of Medical Genetics standards and guidelines for interpretation and reporting of postnatal constitutional copy number variants. Genet Med 2011;13:680-5.
3. Jez S, Martin M, South S, Vanzo R, Rothwell E. Variants of unknown significance on chromosomal microarray analysis: parental perspectives. J Community Genet 2015;6:343-9.
4. Manning M and Hudgins L. Array-based technology and recommendations for utilization in medical genetics practice for detection of chromosomal abnormalities. Genet Med 2010;12:742-5.

