삼성서울병원 소아청소년과
전통적으로 소아고형암의 진단은 종양 조직의 병리학적 진단을 기반으로 하였으나, 형태학적 진단만으로는 질환의 다양한 임상적 경과를 설명하기에 충분하지 않은 경우가 많았다. 분자유전학적 기법이 발달하고 임상 영역에 도입되면서 소아고형암의 진단, 예후군 분류 및 치료에도 많은 변화가 생겨나고 있다.
고형암 진단에서의 중요성 차세대염기서열분석 (Next generation sequencing; NGS)이 도입되기 전에도 몇가지 분자유전학적 바이오마커가 소아고형암의 진단 및 예후군 분류에 이용되어 왔다. 예를 들어, 소아고형암 중 단일 암종으로 가장 흔한 종양인 신경모세포종 (neuroblastoma)에서는 MYCN 유전자의 증폭 (amplification) 혹은 분절염색체변화 (segmental chromosomal alteration)가 있는 경우 불량한 예후를 보인다는 것이 알려져 왔으며,이 중 특히 MYCN amplification은 매우 강력한 예후인자로 신경모세포종 위험군 분류에 중요한 지표로 포함되어 왔다 [1, 2]. 횡문근육종 (rhabdomyosacoma)은 형태학적으로 배아형 (embryonal type)과 포상형 (alveolar type)으로 나누고, 일반적으로 포상형 횡문근육종의 예후가 불량한 것으로 알려져 왔으나, 최근에는 형태학적 분류 보다는 FOXO1 유전자의 전좌 (translocation)의 존재가 예후에 더 중요한 것으로 확인되었다 [3]. 이 외에도 EWSR1 유전자의 전좌는 Ewing 육종 혹은 결합조직성 소원형세포종양 (desmoplasticsmall round cell tumor; DSRCT)의 진단에 중요한 바이오마커로 활용되고 있다.
이전의 MYCN 증폭 혹은 FOXO1, EWSR1 유전자의 전좌 등이 주로 FISH (Flourscence in situhybridization) 검사로 확인이 되었다면, 최근에는 NGS가 소아고형암의 진단에도 많이 응용이 되고있다. 특히 이러한 분자유전학적 진단과 형태학적 진단을 통합한 통합진단 (Integrated diagnosis)은 특히 중추신경계 종양에서 그 역할이 두드러지고 있다. 2016년도에 개정된 중추신경계 종양의 WHOclassification 에서는 기존의 형태학적 진단에 분자진단을 통합하여 진단과 예후군 분류를 보다 정확히 하고자 하였다. 분자유전학검사에 따라 기존의 진단 분류가 세분화 되거나 혹은 새로운 진단 분류가 생기기도 하였는데, 예를 들어 H3의 변이를 동반한 diffuse midline glioma-histone H3 K27Mmutant 라는 새로운 진단 분류가 생겼으며, 예후가 매우 좋지 않은 종양으로 알려져 있다. 한편, 드문암종에서는 형태학적 진단으로 정확한 진단 분류를 하기 어려운 경우들이 있으며, 이런 경우에 NGS 검사 결과가 진단에 도움을 주기도 한다. 실제로 NGS를 임상에 적용한 연구에서 약 3-5%의 환자에서 NGS 검사 후 진단이 변경된 것이 보고되기도 하였다 [4, 5].
우리나라가 NGS 패널의 급여로 인해 분자진단이 비교적 잘 되고 있는 나라임에도 불구하고, 분자진단 분류의 발전속도를 임상 현장이 따라가지 못하고있는 상황도 발생하고 있다. 예를 들어, 소아뇌종양의 일종인 수모세포종 (medulloblastoma)에서의 분자유전학적 진단 및 그에 따른 예후군 분류는 매우 복잡한데, 여러 연구에 의해 수모세포종 안에는 WNT, SHH, Group 3, Group 4로 명명된 최소 4개의 molecular subgroup이 존재한다는 것이 알려졌으며, 이것이 2016년 WHO 분류에도 포함이 되었다. 더 나아가 이 molecular subgroup을 기반으로 하고, TP53, MYC amplification, chromosomeloss 등 DNA 이상소견을 종합한 새로운 위험군 분류가 제시되었다 (그림1) [6, 7]. 이 중 특히 WNT subgroup은 예후가 매우 좋은 것으로 알려져 있다. 현재 많은 국가에서 수모세포종 WNT group에서는 치료 강도를 낮추는 임상시험을 진행 중이어서, 환자들에게 과하지도, 덜하지도 않은 맞춤치료를 시행하기 위하여는 위험군 분류를 제대로 하는 것이 필요하다. 문제는, 이 네 개의 molecular subgroup을 나누는 표준적 검사법이 methylation profiling 혹은gene expression profiling 이어서, 실제로 이러한 검사들이 의료기관 내 혹은 CLIA 인증기관에서 시행되고 있지 않은 나라들이 대부분이고, 국내에서도 NGS, 면역조직화학염색 (immunohistochemistry;IHC)등으로 보완하거나, 혹은 외부 검사실에서 일부검사를 하고 있지만, 임상에 완전히 도입되었다고 보기는 어려운 상황으로 앞으로 해결해 나가야할 숙제라고 하겠다.
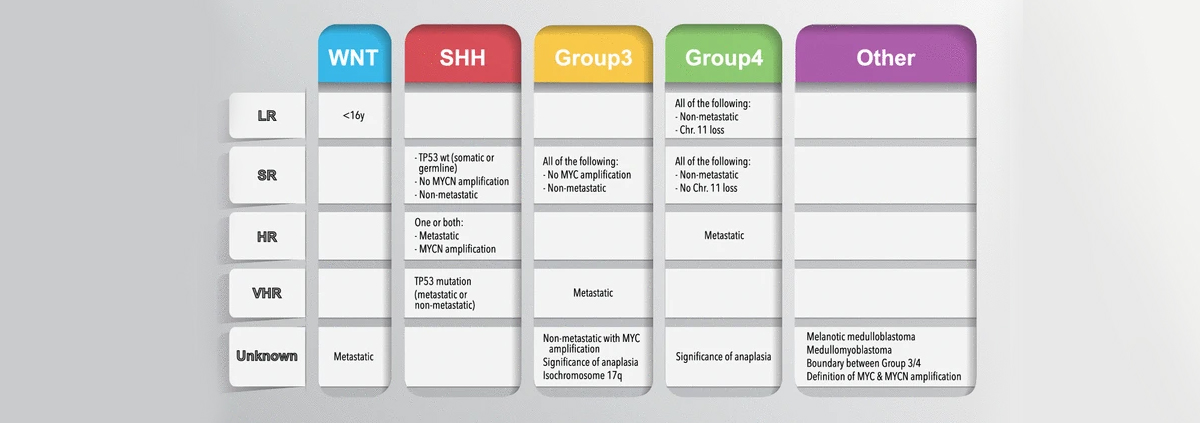 그림1. 수모세포종에서 분자유전학적 검사를 기반으로 한 새로운 위험군 분류
그림1. 수모세포종에서 분자유전학적 검사를 기반으로 한 새로운 위험군 분류
고형암 치료에서의 중요성 성인암에서만큼 활발하지는 않지만, 소아고형암에서도 종양유전체 검사 결과에 따라 해당되는 표적항암제 혹은 면역항암제를 시도하는 임상시험이 점차늘어나고 있다. 성인암과의 차이점은 개별 암종마다 충분한 환자수를 확보하기 어렵기 때문에, 다양한암종을 대상으로 하는 basket trial이 주가 되고 있다는 점이다. 미국 국립암연구소 (National CancerInstitute; NCI)에서 미국소아암학회 (Children’soncology group; COG) 와 함께 시행하는 NCIpediatric MATCH 임상연구에서는 재발성 암을 대상으로 종양 유전체 검사를 시행하고, 해당되는 유전적 변이가 있는 경우 해당되는 임상시험에 등록하는 형태의 basket trial 이 진행되고 있으며, 2021년 11월 현재 총 13개의 arm이 운영되고 있다. 그 외에도 캐나다, 독일, 프랑스, 호주 등 세계 각국에서는 유전체 프로파일링을 진단 및 치료에 응용하는 정밀의료 플랫폼을 운영하고 있다 (그림2) [8].
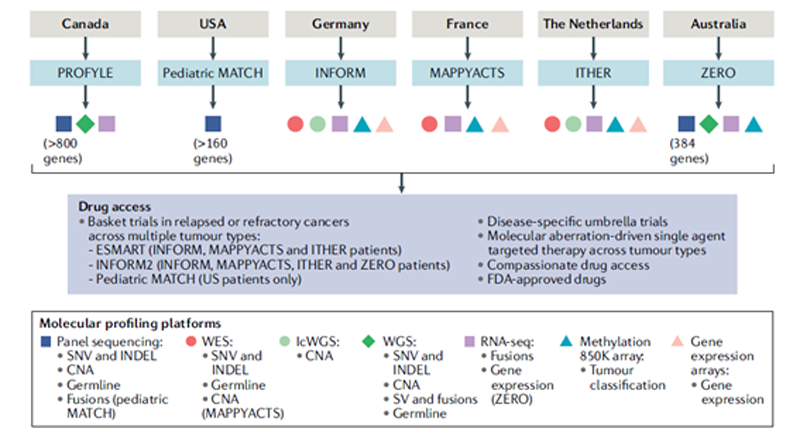 그림2. 각 나라의 소아청소년암 정밀의료 플랫폼
그림2. 각 나라의 소아청소년암 정밀의료 플랫폼
실제로 이러한 접근을 통해 이전에는 치료가 불가능하였던 암에서 좋은 치료효과를 보이면서 생존기간이 증가되는 것이 확인되고 있다. 예시로, 저등급교종 (low grade glioma)은 BRAF fusion을 많이 동반하는 것으로 알려져 있는데, 재발한 저등급교종을대상으로 MEK 억제제를 사용한 임상시험에서 뚜렷한 치료 효과가 있는 것이 확인되었다 [9]. 최근에는TRK fusion 양성인 종양을 대상으로 TRK 억제제를 사용한 임상시험이 79%의 매우 높은 반응율과오랜 반응지속기간을 보이면서 단시간에 미국 FDA와 국내 KFDA의 허가를 얻기도 하였다 [10]. 특히, 이 허가는 종양의 형태학적 진단과 무관하게 NTRKfusion이 있는 모든 종양을 대상으로 허가가 되었다는 점이 기존 약제들과의 차이점이다
국내에서도 유전체 진단에 기반한 임상시험들이 다수 진행되고 있고, 허가 약제들도 점점 늘어남에 따라 소아고형암, 특히 재발성/불응성 암에서의 유전체 진단은 점점 그 중요성이 커지고 있다.
이와 같이, 소아고형암에서 유전체 검사는 정확한진단과 예후군 분류를 가능하게 하여 환자별 맞춤치료가 가능하게 함과 동시에, 새로운 moleculartargeted drug 적용의 가능성을 제시할 수 있다.한편으로는 성인암보다 유전체 변이가 적고, fusion과 같은 구조적 변이(structural variant)가 더 많은소아암의 특성상, 기존에 개발된 패널검사 만으로는여전히 유전체 진단의 한계가 있을 수 있다는 문제가 있다. 이에 보다 광범위한 유전체 검사 등을 적용하려는 노력도 필요하다고 하겠다.
[참고문헌]
1. Janoueix-Lerosey, I., et al., Overall genomic pattern is a predictor of outcome in neuroblastoma. J Clin Oncol, 2009. 27(7): p.1026-33.
2. Schleiermacher, G., et al., Segmental chromosomal alterations have prognostic impact in neuroblastoma: a report from the INRG project. Br J Cancer, 2012. 107(8): p. 1418-22.
3. Missiaglia, E., et al., PAX3/FOXO1 fusion gene status is the key prognostic molecular marker in rhabdomyosarcoma and significantly improves current risk stratification. J Clin Oncol, 2012. 30(14): p. 1670-7.
4. Harris, M.H., et al., Multicenter Feasibility Study of Tumor Molecular Profiling to Inform Therapeutic Decisions in Advanced Pediatric Solid Tumors: The Individualized Cancer Therapy (iCat) Study. JAMA Oncol, 2016.
5. Wong, M., et al., Whole genome, transcriptome and methylome profiling enhances actionable target discovery in high-risk pediatric cancer. Nat Med, 2020. 26(11): p. 1742-1753.
6. Northcott, P.A., et al., Medulloblastoma comprises four distinct molecular variants. J Clin Oncol, 2011. 29(11): p. 1408-14.
7. Ramaswamy, V., et al., Risk stratification of childhood medulloblastoma in the molecular era: the current consensus. Acta Neuropathol, 2016. 131(6): p. 821-31.
8. Jones, D.T.W., et al., Molecular characteristics and therapeutic vulnerabilities across paediatric solid tumours. Nat Rev Cancer, 2019. 19(8): p. 420-438.
9. Fangusaro, J., et al., A phase II trial of selumetinib in children with recurrent optic pathway and hypothalamic low-grade glioma without NF1: a Pediatric Brain Tumor Consortium study. Neuro Oncol, 2021. 23(10): p. 1777-1788.
10. Hong, D.S., et al., Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol, 2020. 21(4): p. 531-540.

