Nortable Research
Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2021 update & SF v3.0 list
Technology Trend 최신 보험정보한양대학교병원 진단검사의학과
2013년 American College of Medical Genetics and Genomics (ACMG)에서는 exome 혹은 genome sequencing (ES/GS)에서 발견된 actionable gene의 known pathogenic (KP) 또는 expected pathogenic (EP) variant를 보고하도록 권고하는 지침을 발표했습니다. 또한 목적한 질환이나 유전자 외에 이렇게 우연히 발견된 변이들을 “Secondary finding (SF)”으로 정의하고, 최소한의 유전자 목록을 제시하였습니다. 2017년에 해당 목록을 업데이트하면서 4개 유전자가 추가되고 1개 유전자가 삭제되었습니다. 이후 SF Working Group (SFWG)는 실제 임상에서 SF 정보가 받아들여지고 이용되는 방식과 인종별 빈도에 대한 연구를 검토하였으며 이를 바탕으로 다음과 같은 여러 가지 측면을 고려하여 새로운 권고안을 발표했습니다.
1) SF 결과 제공에 대한 동의 이전 권고안은 SF를 보고하는 것을 원칙으로 하였으나, 현 권고안부터는 동의서를 받을 때 SF 정보를 받지 않을 수 있는 선택지를 줄 것을 권고합니다. 동의는 자율성과 결과에 따른 이득, 무해성의 원칙에 입각하여 결정되어야 합니다. 동시에 미성년자에게 검사를 시행할 경우 성인기에 발병할 수 있는 질환의 위험을 알리는 것이 우선적으로 중요한 사안임을 고려해야 하며, SF를 확인하는 것은 부모들이 자녀가 가진 치명적 유전적 위험요소를 알 수 있는 유일한 기회일 수도 있습니다.
또한 환자에게 SF 결과의 범위와 적응증을 설명해야 하며 필요에 따라 동의서에 유전정보에 근거한 차별에 관한 법률 적용에 대한 내용을 포함할 수 있습니다. 이 권고안에서 제시하는 SF 목록은 최소한이며 필요시 추가할 수 있습니다. 이 경우 동의서에 보고 할 유전자를 모두 포함해야 합니다.
가족력이 없는 환자에서 pathogenic (P) 혹은 likely pathogenic variant (LP)가 발견될 경우 침투도가 떨어질 가능성이 있으며, 추후 의학적 처치를 권고할 때 실제 임상양상을 고려해야 합니다. 또한 체세포의 모자이시즘이 발견될 가능성 또한 고려해야하는데, 특히 나이든 사람에서 발견되는 clonal hematopoiesis of indeterminate potential (CHIP)이나 이전에 암에 걸려 치료를 받은 경우가 해당합니다. 필요시 해당 내용 또한 동의서에 포함 할 수 있습니다.
> Policy recommendations
- 권고안의 SF 목록은 actionable한 유전자의 최소 목록입니다.
- 환자가 원한다면 동의서를 받을 때 SF 정보를 제공받지 않을 선택지를 제공해야 합니다.
- 기형 등으로 시행하는 산전 ES/GS에서도 SF를 받지 않을 선택지를 제공해야 합니다.
- 동의를 받을 때 SF 목록에 어떤 유전자-질환이 있는지 설명해야 합니다.
- SF에서 의미있는 소견이 발견된 경우 추가적인 의학적 처치에 대한 권고를 해야합니다.
- SF에 해당하는 체세포 모자이시즘을 보고할 경우 이는 동의서에 명시되어야 합니다.
- 검사 전후 유전상담은 SF 결과를 받는 모든 사람에게 제공되어야 하며, 가능한 결과, 검사의 한계, 결과에 따른 의학적 영향에 대한 내용이 포함되어야 합니다.
2) ES/GS이외의 검사에서 SF 보고 여부 이전 권고안에서 ES/GS를 시행할 경우 SF의 최소 목록에 대한 변이를 보고할 것을 권고했습니다. 또한 유전자 패널이나 virtual panel인 경우 또한 마찬가지로 권고했으나, 다음과 같은 논의점들이 대두되었습니다.
우선 일반적으로 시행되는 유전자 패널 검사 시행 시 ES/GS 시행 시에 비해 문서화된 동의서가 없을 가능성이 있으며, 유전 전문가가 아니라면 유전자 검사 동의서에 필요한 내용이 누락될 가능성이 있습니다. 따라서 SF에 대해 수진자에게 적절한 동의를 획득하지 못하거나 추가 동의가 필요한 상황이 발생할 수 있습니다. 둘째로, 일반적인 유전자 패널 검사 시에도 SF를 보고하는 것은 검사실의 업무 부담을 증가시킬 수 있습니다. 유전자 패널 검사 보고를 위해 exome capture kit를 썼더라도 SF 정보를 확인하기 위해서는 훈련된 전문가에 의한 추가적인 분석과 임상적인 검토가 필요하기 때문입니다. 마지막으로 유전자 패널이 SF 최소 목록을 모두 포함하지 않는 경우 SF에 대한 정확한 결과를 도출하지 못할 수 있고, 수진자에게는 전체 SF 유전자를 검사했다는 오해를 불러올 수 있습니다.
> Policy recommendations
- SF에 대한 권고안은 의료진이 임상적인 목적으로 ES/GS를 처방할 경우 적용합니다.
- Non genome-wide test (gene panel, virtual panel 등)에서는 SF를 보고하지 않아도 됩니다. 하지만 만약 이런 검사에서 SF를 보고한다면 ES와 동일하게 필요한 내용을 담은 동의를 받아야 하며, 최소한의 SF 목록을 모두 포함해야 합니다.
- 현 시점에서 Mitochondrial DNA sequencing에서 발견된 소견은 SF로 고려하지 않습니다.
- SF를 보고하는 것은 임상적 목적으로 검사를 시행 할 때이며, 연구 목적으로 시행한 경우는 해당 연구진과 IRB의 논의에 따라 결정해야 합니다.
3) 변이의 분석 성능(analytical validity)에 대한 고려 현재 시행되는 ES/GS로 확인이 어려운 종류의 변이가 발견되는 유전자를 SF 목록에 넣을 것인지에 대해 논의되었습니다. 이러한 변이는 actionable gene이라 하더라도 ES/GS에서 검출되지 않아 민감도가 떨어질 수 있고, 추가적인 검사로 확진하기도 어려울 수 있습니다. 분석 성능을 고려할 때 SF 목록에 포함되기 어려운 경우는 다음과 같습니다.
a. 하나 이상의 pseudogene이 있는 유전자들과 recombination이나 gene-conversion event를 유발하는 homologous sequence가 있는 유전자들은 ES/GS에서 검출이 어렵습니다. (예.CYP21A2)
b. pharmacogenic (PGx) phenotype에 연관된 유전자/변이들은 특정 약물 치료에 임상적 유용성이 있지만 1) 많은 경우 변이가 intronic region에 있어서 현재의 standard reagent로 capture하지 못하고 반복서열인 경우 ES에서 검출이 어려우며, 2) 일부 변이와 유전자는 약물역동학에 미치는 영향이 명확하지 않고, 3) PGx 유전형은 하나의 유전자에서도 여러 부위를 확인해야 하므로 분석과 해석이 복잡합니다.
c. 유전자 내 exon-level copy number variant (deletion/duplication)이 흔히 질환의 원인이 되는 유전자들은 ES로 검출이 어렵습니다 (예.MSH2, EPCAM)
> Policy recommendations
- SF 목록은 일반적인 ES/GS에서 확인 가능한 임상적으로 의미있는 주요 유전자만을 포함해야 하며 발견된 변이들은 검사실에서 다른 방법으로 확진이 가능해야 합니다.
- ES의 기술적 한계 때문에 배제된 일부 유전자와 변이가 GS에서는 검출 가능할 수 있지만 해당 권고안에서는 ES/GS에 적용되는 SF 목록에 차이를 두는 것은 권고하지 않는다.
4) ACMG/AMP 가이드라인 업데이트에 맞춰 변이 분류 수정 이전 권고안에는 “이전에 보고되었거나(known pathogenic, KP), 보고된 적은 없지만 질환을 일으킬 것으로 예상되는 변이(expected pathogenic, EP)”라고 칭했으나, 최근 ACMG/AMP 가이드라인에 맞추어 용어를 변경 적용하였습니다. 이를 위해 Likely pathogenic (LP)가 EP를 반영할 수 있는지 변이를 재분석(reanalysis)한 문헌들을 고찰하였고, LP의 정의인 90% 이상 pathogenic 할 것으 로 생각되는 변이를 만족한다는 것을 확인하였습니다. 또한 SF를 보고하는 목적이 의학적 처치가 가능한 actionable variant의 존재에 주의를 기울이게 하기 위함이었는데, LP 또한 동일한 효과를 나타낼 수 있음을 확인하였습니다. 실제로 actionable LP를 보고하지 않는 경우가 나중에 하향조정될 가능성이 있는 LP를 보고하지 않는 경우보다 더 위험하기 때문입니다.
또한 SF 목록 중 novel variant가 발견된 경우 Loss- of-function variant만 보고하는 안과 같은 더 보수적인 방안도 고려하였으나, 최근 ACMG/AMP 가이드라인이 novel missense variant를 LP로 판정하는 데 까다로운 기준을 적용하고 있고, LP가 VUS로 하향조정되는 경우가 적으므로 SF 목록에 해당하는 모든 LP와 P를 보고하는 것을 권고하기로 결정하였습니다. LP 이상으로 분류된 변이라면 actionable할 가능성이 높고, 추후 일부 LP들이 하향조정되더라도 이 변이에 관한 근거들이 누적될 것이기 때문입니다. 그러나 현재로서는 변이 재분류의 빈도나 정도에 대한 권고안이 부족한 현실이며, 해당안이 재분류의 기준을 개발하는데 도움이 되기를 바랍니다.
> Policy recommendations
- ACMG v.3.0 목록에서 특별히 지정하지 않는 한, ACMG 가이드라인에 따라 P/LP로 분류되는 모든 변이들은 보고되어야 합니다. KP와 EP용어는 더 이상 사용하지 않습니다.
- VUS, LB, B로 분류되는 변이는 SF에서는 보고하지 않습니다.
- 이 권고안과 v.3.0 목록 적용 전에 시행된 검사들은 수정하지 않아도 됩니다.
5) SF로 보고하는 유전자와 변이의 범위 특정 변이 유형: 어떤 유전자들은 특정한 변이에 국한하여 의학적으로 처치 가능한(actionable) 양상을 보이기도 합니다. 하지만 해당 권고안에서는 전체 유전자에서 발견된 모든 P/LP를 보고하는 것을 원칙으로 합니다.
양성예측율과 침투도: 기존 권고안은 침투도의 기준을 정하지 않고 “높은 침투도를 보이는 질환군” 으로 정의했습니다. SF은 임상적으로 위험성이 높은 유전자의 P/LP 변이를 선택적으로 보고함으로써 양성예측율이 높은 변이를 확인하는 것이 목적입니다. 따라서 분석적 측면에서 양성예측율을 떨어트리는 pseudogene 의 존재나 임상적 측면에서 양성예측율에 영향을 주는 낮은 침투도를 보이는 유전자를 포함하는 것은 권고하지 않습니다. 침투도는 나이, 표현형, 성별, 유전자, 환경 등에 따라 달라질 수 있으며, 동일한 표현형을 나타내는 유전자들 사이에서도 다양합니다. 또한 germline cancer risk gene 의 침투도는 질병에 이환된 가족들을 적극적으로 확인하기 때문에 다소 과장되어 있습니다. 여러 유전자에서 시간이 지나 데이터가 쌓이고 다양한 인구집단의 결과를 포함해 고려할수록 침투도는 떨어지는 경우가 많습니다. 그러므로 가능하다면, 이환 유무에 상관없이 염기서열 분석을 시행한 큰 규모의 코호트에서 예측된 lifetime penetrance를 이용할 것 이 권고됩니다.
> policy recommendation
- 불확실하거나 낮은 침투도를 보이는 유전자-질환을 SF에 포함하지 않을 것을 권고합니다.
- 유전자와 연관된 표현형을 나타낼 가능성이 높은 유전자-질환을 우선으로 고려해야 합니다.
- surveillance/intervention 권고에 따르는 부담과시행 가능성을 고려하여 유전자-질환을 선택하는 안을 고려해야 합니다.
- 침투도에 대한 정보는 이상적으로 다양한 인구집단을 포함한 데이터베이스에서 얻어야 합니다.
6) 연간 SF 목록 갱신 계획 SFWG는 매년 SF 목록에 대해 Major/minor revision을 시행할 예정입니다. 주요한 변화가 있거나 유전자-질환의 유형 및 가짓수가 변경될 경우는 Major revision이며, 이는 version의 숫자로 표시됩니다(예. v3.0, v4.0 등). 한 두 개 유전자나 변이가 추가 혹은 삭제되는 경우는 Minor revision으로 “.”뒤의 숫자로 표시됩니다(예. v3.1, v3.2 등). 검사할 당시의 기준을 적용하여 보고서를 작성하면 되고, 새로운 버전이 나오더라도 이전 보고서를 수정할 필요는 없습니다.
이러한 논의를 바탕으로 SF list v3.0을 발표되었고 추가된 유전자의 목록은 아래와 같습니다.
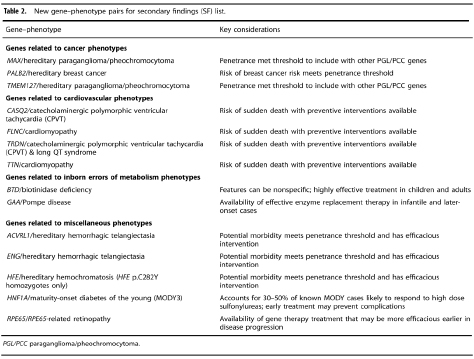 Table 1. New gene-phenotype pairs for secondary findings list
Table 1. New gene-phenotype pairs for secondary findings list
[참고문헌]
[1] Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2021 update: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 2021 May 20. doi: 10.1038/s41436-021-01171-4.
[2] ACMG SF v3.0 list for reporting of secondary findings in clinical exome and genome sequencing: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 2021 May 20. doi: 10.1038/s41436-021-01172-3.

