TECHNOLOGY TREND
신의료기술 취득 : 림프구 종양의 Clonality 확인 및 MRD monitoring을 위한 LymphoTrack assay
Focus on Nortable ResearchLymphoTrack은 차세대염기서열분석(NGS) 기반 clonal antigen receptor gene rearrangement assay로, 2020년 8월에 신의료기술을 취득하였다.
<신의료기술의 안정성 유효성 평가 결과 고시>
· 801호, IGH 유전자 재배열 검사 [염기서열검사]
· 802호, IGH / IGK 유전자 재배열 검사 [염기서열검사]
· 803호, T세포 수용체 베타 / T세포 수용체 감마 유전자 재배열 검사 [염기서열검사]
다른 체세포와 달리, 림프구는 성숙 과정 중 antigen receptor 유전자(IGH, IGK, TRB, TRG)의 genomic DNA가 재배열 단계를 거치면서, 림프구마다 고유한 재배열 DNA를 갖게 된다. 혈액암은 개별적인 림프구가 암세포로 형질 전환되어 혈액 내에서 증식하는 질환이므로, 림프구계 종양 세포들은 특이적인 재배열 DNA를 공유하게 된다. 이러한 재배열 DNA에 대한 검사는 PCR 후 전기영 동을 이용한 절편분석법으로 시행됐으나, 최근에는 NGS 기반의 검사가 개발되었고, 2019년 3월, KSGD News Forum 5에서 NGS 기반의 검사법인 LymphoTrack 검사가 소개된 바 있다. NGS 기반의 검사는 PCR 산물의 절편 길이뿐 아니라 염기서열을 추가로 확인한다는 점으로 인해 PCR 기반의 검사에 비해 높은 민감도와 특이도 갖고, Ultra deep sequencing을 통해 0.01~0.001%까지의 민감 를 확보할 수 있다. 이러한 결과를 바탕으로 NGS 기반의 림프구 수용체 유전자 재배열 검사가 위와 같이 신의료기술허가를 획득하였다. 본 호에서는 해당 기술을 이용하여 림프구 증식성 종양의 MRD 검사가 실제 이루어지는 방식 및 2019년 이후 개선된 LymphoTrack 검사의 내용을 간략히 소개하고자 한다.
 그림 1. NGS 기반 림프구 수용체 유전자 재배열 검사의 신의료기술 허가 현황
그림 1. NGS 기반 림프구 수용체 유전자 재배열 검사의 신의료기술 허가 현황
1) 스크린 검사.
림프구 증식성 질환 환자의 골수 또는 말초 혈액을 채취 후 림프구 수용체 DNA 재배열 양상을 통해 monoclonality를 확인하는 검사이다. 검체 내 전체 림프구의 재배열 DNA를 염기서열분석하여, 고유한 재배열 DNA 염기서열 별로 차지하는 비율(proportion)을 기준으로 순위(ranking)를 매긴다. 그림 2의 기준을 만족하는 고유한 재배열 DNA를 monoclonal sequence로 판단하고, MRD(Minimal Residual Disease) 모니터링 검사의 추적 대상으로 사용한다. 향후 MRD 모니터링 검사가 시행되기 위해서는 반드시 “치료 전 검체” 를 활용한 스크린 검사를 통해 추적 대상 클론의 확인이 선행되어야 한다.
2) 미세잔존질환(MRD, Minimal Residual Disease) 모니터링 검사.
MRD 검사는 스크린 검사에서 확인된 clonal read가 모니터링 검체에서 발견되는지를 확인하는 것을 목표로 한다. 모니터링 검체에서 clonal read가 확인될 경우 clonal read count와 clonal read frequency(%), cell equivalent, clonal cell frequency(%) 형식의 결과로 보고한다. 추적 중인 clonal read가 MRD 검사에서 발견되지 않는다면, “Not detected”로 보고한다.
식약처는 미세잔존질환(MRD) 양성인 전구 B세포 급성 림프모구성 백혈병(ALL) 환자에게 블리나투모맙(블 린사이토주, 암젠) 처방을 허가하였다. LymphoTrack은 MiSeqDx 장비와 250ng 이상 DNA 검체 조건에서 10-4 민감도(0.01%) 수준의 검사가 가능하다.
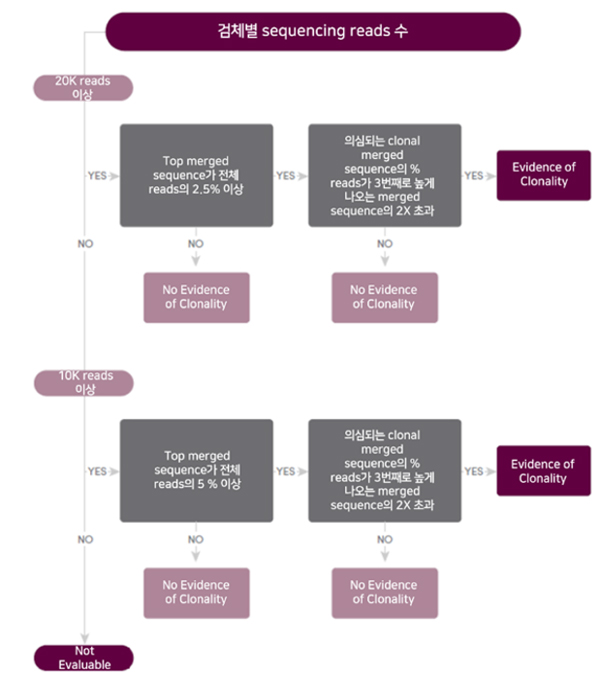 그림2. LymphoTrack 스크린 검사, monoclonality 판독 기준 (제조사 자료)
그림2. LymphoTrack 스크린 검사, monoclonality 판독 기준 (제조사 자료)
3) LymphoQuant internal control(LQIC) 활용한 cell equivalent 계산
LymphoTrack을 활용한 MRD 검사는 전체 림프구 집단에서 유래한 재배열 DNA 중 추적 대상 림프구의 재배열 DNA 비율(proportion, %)로 표기한다. 해당 비율은 read depth의 비율을 통해 계산되는데, 항암치료에 따른 림프구감소증(lymphopenia)은 MRD 모니터링 검사 결과의 분모를 많이 감소시킨다. 이러한 림프구감소증의 정도는 LQIC를 통해 간접적으로 측정될 수 있다. LQIC는 모든 검체에 혼입(spike-in)되는 림프구 세포 주로서, 혼입되는 LQIC의 양은 림프구 100개에 상응한다. LQIC 내 재배열 DNA는 검체 내 전체 림프구 수에 따라 비율(proportion, %)이 다르게 나타나는데, LQIC 고유 염기서열의 비율(%) 증가는 검체 내 림프구 감소를 반영한다. 또한, LQIC로 추적 대상의 재배열 DNA의 비율(%)을 cell equivalent로 표기할 수 있다. Cell equivalent는 LQIC와 특정 재배열 DNA의 비(ratio)를 통해 계산되며, LQIC 재배열 DNA 비율(proportion) 이 언제나 세포 수 100개를 반영한다는 가정이 적용된다.
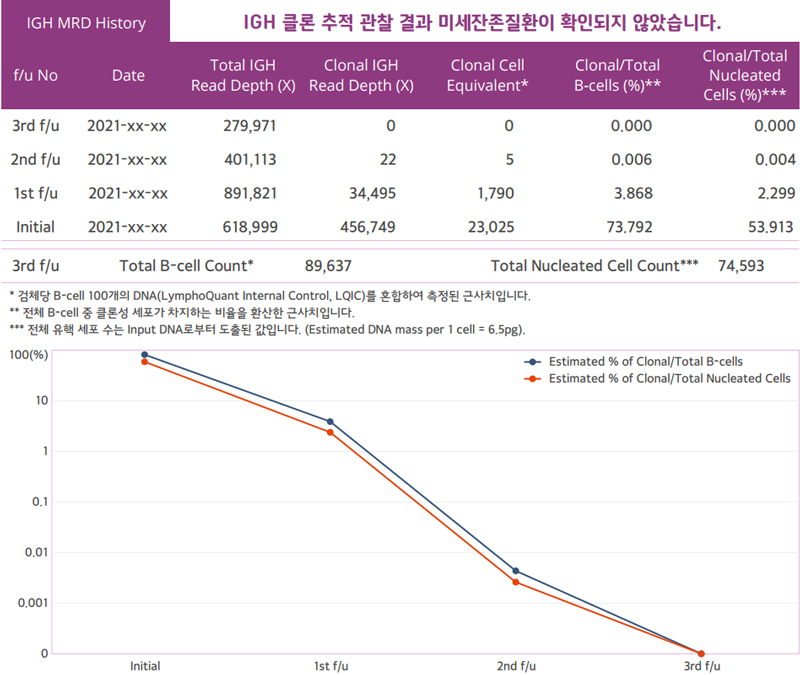 그림3. GC녹십자지놈 MRD 검사 레포트 예시
그림3. GC녹십자지놈 MRD 검사 레포트 예시
4) 유핵세포(nucleated cell) 기준 clonal cell frequency 보고.
림프구 유래 재배열 DNA의 비율(proportion)로 보고되는 LymphoTrack 결과는 림프구감소증 등 검체 내 전체 림프구 수량에 영향을 받는다는 문제점을 안고 있다. 이에 LymphoTrack에서는 아래와 같은 수식으로 전체 유핵세포를 분모로 한 clonal cell frequency를 계산하여 제공한다.
[수식 표현] % of clonal lymphocyte among nucleated cell = monoclonal read cell equivalent / estimated nucleated cell equivalent
유핵세포 한 개에서 추출한 DNA양은 대략 6.5pg으로 알려져 있다. ii LymphoTrack 활용한 MRD 검사 시에 DNA 검체량(ng)은 비례식을 통해 nucleated cell equivalent로 변환할 수 있다. 일반적인 검체량 250ng은 약 38,462 cell equivalent로 변환되며, 10-4 민감도(0.01%)를 충족하기 위한 유핵세포 수량으로서 적합하다.
[결론] 높은 민감도와 임상적 유용성의 LymphoTrack MRD Assay가 전구 B-ALL 환자의 완전 관해 후 MRD 존재 여부를 판단하는 검사로서 기여하고, ALL뿐만 아니라 CLL, MM, Lymphoma 등 림프구 증식성 질환으로 적응증을 넓혀 새로운 진단과 모니터링 방법을 제공할 수 있기를 기대한다.
[참고문헌]
i 신의료기술평가 결과 자료,
ii Fabianova, B., Kropacova, K. & Misurova, E. DNA content and size of cell nuclei in the regenerating rat liver. Bull Exp Biol Med 83, 426–428 (1977). https://doi.org/10.1007/BF00799384
# LymphoTrack 제조사의 Instrument For User 자료에 근거하여 작성되었습니다.
1. IFU_IVS_LymphoTrackDx_IGHV_Leader_280351 (June 2020)
2. IFU_IVS_LymphotrackDx_IGH_FR1_FR2_FR3_280389 (June 2020)
3. IFU_IVS_LymphotrackDx_TRG_280346 (June 2020)
4. Study Guideline of LymphoTrack MRD solution (March 2021)

